
【题目】某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的 NaOH 溶液,溶液中pOH 与 pH 的变化关系如图所示,则正确的是( )
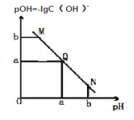
A. M 点所示溶液导电能力强于 Q 点
B. N 点所示溶液中 c(Na+)>c(CH3COO-)
C. Q 点所示的溶液 pH 一定等于 7
D. Q 点加入 NaOH 溶液的体积等于醋酸溶液的体积
【答案】B
【解析】
酸溶液中pOH越大,说明溶液中氢氧根离子浓度越小,溶液氢离子浓度越大,酸性越强,随着NaOH的加入,发生中和反应,溶液氢氧根离子的浓度逐渐增大,则溶液pOH逐渐减小,pH逐渐增大,结合弱电解质的电离解答该题。
A.因为醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,故A错误;
B.N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),所以B选项是正确的;
C. Q点的pOH=pH,溶液为中性,由于温度不一定是室温,所以pH 不一定等于7,故C错误;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,则所加NaOH溶液体积略小于醋酸溶液的体积,故D错误。
所以B选项是正确的。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 H2X溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是

A.水电离出来的c(OH-):D点>B点
B.C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+)
C.B点:c(HX-)>c(H+)>c(X2-)>c(H2X)
D.A点溶液中加入少量水:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为 ![]() 。有机物X的键线式为:
。有机物X的键线式为:

(1)有机物X的分子式___________________
(2)有机物Y是X的同分异构体,属于芳香烃,写出Y的结构简式 _______________________________________________________
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_______。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是____________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。
注意事项:
1、本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2、密封保存,请勿与洁厕灵同时使用。
3、保质期为一年。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有![]() 个氩原子的氩气在标准状况下的体积约为22.4L
个氩原子的氩气在标准状况下的体积约为22.4L
B.标准状况下,11.2L![]() 含有的分子数为0.5
含有的分子数为0.5![]()
C.在常温常压下,11.2 L ![]() 含有的分子数为0.5
含有的分子数为0.5![]()
D.常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。已知X的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有1个电子。下列说法正确的是( )
A. 离子半径:![]() B. Z和Y形成的化合物可能含有非极性键
B. Z和Y形成的化合物可能含有非极性键
C. 氢化物的稳定性:![]() D. 最高价氧化物对应水化物的碱性:
D. 最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是____;氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是____。
(2)若采用下图实验装置将四氯化碳和I2的混合溶液分离。
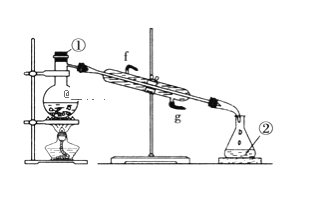
写出图中仪器的名称:①____;该装置还缺少的仪器是__;冷凝管的进水口是:__(填g或f)。
Ⅱ.我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸密度为1.19 g/cm3配制成250mL 0.1mol·L-1的盐酸溶液。
(1)配制上述溶液除250mL容量瓶、烧杯、胶头滴管、量筒外还需要的玻璃仪器是___。
(2)根据计算,需要36.5%的浓盐酸的体积为______mL。
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)_______。
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)假设配制时其他操作均正确,只出现以下哪种情况时,会造成所配制的溶液浓度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸馏水
B.定容时仰视容量瓶读数
C.定容时俯视容量瓶读数
D.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知氯气通入热的苛性钠溶液中会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中还原剂是___(填化学式);把此反应改写成离子方程式:___;
(2)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:3Cl2+6NaOH=5NaCl +NaClO3+3H2O。___
(3)若生成1mol的NaClO3,转移的电子数是___;若反应中转移了2.5mol的电子,则消耗标况下Cl2的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com