
����Ŀ����.�������岻��ȱ����Ԫ�أ�Ϊ�˷�ֹ��ȱ���������г�������һ�ּӵ��Σ������ھ���������һ������KIO3��ȥ��ij�о�С��Ϊ�˼��ij�ӵ������Ƿ��е⣬�������йص����ϣ���������ԭ���ǣ�KIO3+5KI+3H2SO4��3I2+3H2O+3K2SO4
��1���÷�Ӧ����������____�����������뻹ԭ��������ʵ�������___�������Ӧ����0.3mol�ĵ��ʵ⣬��ת�Ƶĵ�����Ŀ��____��
��2����������ͼʵ��װ�ý����Ȼ�̼��I2�Ļ����Һ���롣
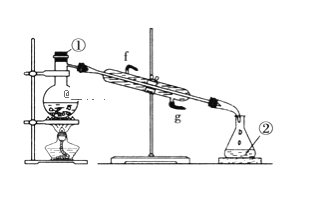
д��ͼ�����������ƣ���____����װ�û�ȱ�ٵ�������__�������ܵĽ�ˮ���ǣ�__����g��f����
��.��У������ȤС���ڴ�����ˮ��Ʒʱ��������������Ϊ36.5%��Ũ�����ܶ�Ϊ1.19 g/cm3���Ƴ�250mL 0.1mol��L��1��������Һ��
��1������������Һ��250mL����ƿ���ձ�����ͷ�ιܡ���Ͳ���Ҫ�IJ���������___��
��2�����ݼ��㣬��Ҫ36.5%��Ũ��������Ϊ______mL��
��3������ȡŨ��������в����Ⱥ�˳����(�ñ�ű�ʾ)_______��
�� ��ϡ�͵������¶�������һ�º��ز�����ע����ѡ����������ƿ�С�
�� ������ƿ��С�ļ�����ˮ��Һ��ӽ����ο̶���1��2 cm�������ý�ͷ�ιܼ�����ˮ��ʹ��Һ����ʹ���ƿ���Ļ��ο̶������С�
�� ��ʢ������ձ���ע����������ˮ�����ò�����������ʹ���Ͼ��ȡ�
�� ������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ��
��4����������ʱ������������ȷ��ֻ���������������ʱ������������Ƶ���ҺŨ�������Ҫ���ֵƫ�ߣ� ��______��
A������ƿ������������ˮ
B������ʱ��������ƿ����
C������ʱ��������ƿ����
D�����Ƶ���Һװ��ྻ�ĵ�����������ˮ���Լ�ƿ��
���𰸡�KIO3 5��1 0.5NA ������ƿ �¶ȼ� g ������ 2.1 �ۢ٢ܢ� C
��������
��.��1�����ݷ�ӦKIO3+5KI+3H2SO4��3I2+3H2O+3K2SO4����Ӧ��Ԫ�ػ��ϼ۽��͵�����������KIO3�Ļ��ϼ۴�+5�۽��͵�0�ۣ��������������������뻹ԭ���ﶼ��I2������6mol��ԭ�ӣ�����5mol���������1mol�ǻ�ԭ������������뻹ԭ������5��1����Ӧ��1mol KIO3��Ӧ����3molI2������ת��5mol��ÿ����0.3mol I2ת�Ƶ������ʵ�����0.5mol��0.5mol���ӵ���Ŀ0.5NA��
�ʴ�Ϊ��KIO3��5��1��0.5NA��
��2����ͼΪ�����������������������������ƿ����װ��������װ�ã����÷е㲻ͬ�Ѹ����ʷֿ���Ϊ��֤������ܳ����룬��Ҫ������������������¶ȣ���ȱ�ٵ��������¶ȼƣ�������������ˮ�������������������෴�����½��ϳ�����Ϊ����������ȴ��ȫ��
�ʴ�Ϊ�� ������ƿ���¶ȼƣ�g��
��1��������ҺʱҪ�õ�����Ϊ250mL����ƿ���ձ�����ͷ�ιܡ���Ͳ���ܽ��ת��Һ�廹��Ҫ��������
�ʴ�Ϊ�� ��������
��2��c(HCl)= ![]() mol/L =11.9mol/L������ϡ��ǰ�����ʵ����ʵ������������㣬����Ҫ11.9mol/L��������ΪV���� 11.9mol/L ��V =0.10 mol/L��0.25L����V=0.0021L=2.1mL��
mol/L =11.9mol/L������ϡ��ǰ�����ʵ����ʵ������������㣬����Ҫ11.9mol/L��������ΪV���� 11.9mol/L ��V =0.10 mol/L��0.25L����V=0.0021L=2.1mL��
�ʴ�Ϊ��2.1��
��3����ȡŨ�����Ҫ���еIJ����ֱ�Ϊ��ϡ�͡���ȴ��ת�ơ�ϴ�ӡ����ݵȲ��裬��ȷ�IJ���˳��Ϊ���ۢ٢ܢڣ�
�ʴ�Ϊ���ۢ٢ܢڣ�
��4��A������ƿ������������ˮ�������Ҫ���ݣ����Բ�Ӱ��ʵ��������A���������⣻
B������ʱ��������ƿ��������ʹҺ�����ƫ����c=![]() ������ҺŨ�Ȼ�ƫС����B���������⣻
������ҺŨ�Ȼ�ƫС����B���������⣻
C������ʱ��������ƿ��������ʹҺ�����ƫС������c=![]() ������ҺŨ�Ȼ�ƫ��C�������⣻
������ҺŨ�Ȼ�ƫ��C�������⣻
D�����Ƶ���Һװ��ྻ�ĵ�����������ˮ���Լ�ƿ�л�ʹ��Һ���ƫ����c=![]() ������ҺŨ��ƫС����D���������⣻
������ҺŨ��ƫС����D���������⣻
�ʴ�Ϊ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽����Һ����Զ�![]() ��Һ�����ƺͱ����Ӱ�졣10mL
��Һ�����ƺͱ����Ӱ�졣10mL![]() ��10mL
��10mL![]() ��Һ�С�
��Һ�С�
I.![]() ��Һ������
��Һ������
��![]() �ֱ�����10mL����ˮ��10mL
�ֱ�����10mL����ˮ��10mL
��Һ��� | �ܼ� | ��Һ��״ | |
�� | ����ˮ | dz��ɫ������Һ�� | �� |
�� |
| ��ɫ������Һ�� | �� |
�� |
| ��ɫ������Һ | �� |
(1)��ƽ���ƶ�ԭ�����͢������Ե���Ҫԭ����________________
(2)�ڡ��۱�췢����Ӧ�����ӷ���ʽ��_______________________
(3)��ͬѧ��Ϊ����һ����+3���������ü������������Һ��,�۲쵽��·:������KSCN�Ģ��е����Լ�a,��Һ���,˵�����ƶ���ȷ���Լ�a��____________
II ![]() ��Һ�ı���
��Һ�ı���
��ʵ��I�����Ƶ�������Һ�ֱ��ڿ����з���24Сʱ��,��¼���¡�
��Һ��� | ��Һ��״ | |
�� | ��ɫ���� | �� |
�� | ��ɫ��Һ | �μ�5�� |
�� | ��ɫ��Һ | �μ�5�� |
���������ۣ��٢�˵�����Լ���ʱ,![]() ��Һ���ױ��ʣ��ڢ�˵������
��Һ���ױ��ʣ��ڢ�˵������
���������ϣ���һ��pH��Χ�ڣ�+2�����Ļ�ԭ�������Լ�������ǿ,�����������������Ե���ǿ����ǿ��
������ʵ�飩����ͼ��ʾװ�����ʵ��(�μ��Լ�ʱ��Һ�������Һ�����Ա仯�ɺ���)�����ҳس����ȶ�ͨ������,��������ʾ���ȶ���:
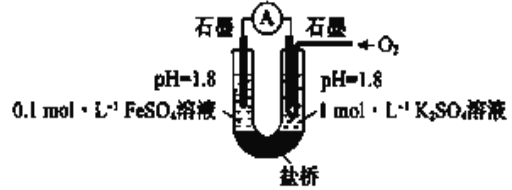
I ����صμ�Ũ������![]() �ӽ�
�ӽ�![]() ������û�����Ա仯
������û�����Ա仯
II ���ҳصμӵ���Ũ���ᣬ������������
(4)��ȫ���������ۣ�:�ڢ�˵��_______________
(5)ii���ҳصĵ缫��Ӧ����ʽ��____________________
(6)����ʵ���ƶϣ��۱Ȣ���![]() ���ױ��ʵ�ԭ����___________________
���ױ��ʵ�ԭ����___________________
(7)������ԭ����װ�����½���ʵ��֤ʵ����![]() ���ױ��ʵ�ԭ��ʵ�鷽����Ԥ��������:���ҳس����ȶ�ͨ������,��������ʾ���ȶ���____________
���ױ��ʵ�ԭ��ʵ�鷽����Ԥ��������:���ҳس����ȶ�ͨ������,��������ʾ���ȶ���____________
(8)����ʵ��,���Ʋ�����![]() ��Һ����ѷ���_________________��
��Һ����ѷ���_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�Ļ�ѧ���������ȷ���ǣ�������
A | Mg(HCO3)2��Һ��������NaOH��Һ��Ӧ | Mg2����2HCO |
B | ����SO2ͨ�뵽NaClO��Һ�У� | SO2��H2O��ClO��===HClO�� |
C | ��Al2(SO4)3��Һ�м��������ϡ��ˮ | Al3 ++4NH3��H2O=AlO2��+4NH4++2H2O |
D | KClO������Һ��Fe��OH��3��Ӧ��ȡK2FeO4 | 3ClO��+2Fe��OH��3��2FeO42��+3Cl��+4H++H2O |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ����� 0.1mol/L ������Һ����μ����Ũ�ȵ� NaOH ��Һ����Һ��pOH �� pH �ı仯��ϵ��ͼ��ʾ������ȷ����( )
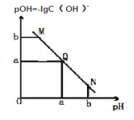
A. M ����ʾ��Һ��������ǿ�� Q ��
B. N ����ʾ��Һ�� c(Na+)>c(CH3COO-)
C. Q ����ʾ����Һ pH һ������ 7
D. Q ����� NaOH ��Һ��������ڴ�����Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����Դ����������������ʮ�ֹؼ������á���Դ��Ϊһ����Դ�Ͷ�����Դ������Ȼ���д��ڵ���Դ��Ϊһ����Դ��ͨ��������ʽ��õ���Դ��Ϊ������Դ�����顢��������Ҫ����Դ���ش��������⣺
��1�����ڼ��顢������˵����ȷ����___
A���������������һ����Դ B��������һ����Դ�������Ƕ�����Դ
C��������������Ƕ�����Դ D�������Ƕ�����Դ��������һ����Դ
��2��![]() �����������Ի�úϳ�����
�����������Ի�úϳ�����![]()
����֪������Ӧ����صĻ�ѧ�������������£�
��ѧ�� | C��H |
| H��H |
|
����/ | 413 | 745 | 436 | 1075 |
��÷�Ӧ��![]() _____
_____![]() ��
��
����֪��![]()
![]()
![]()
![]()
��C��s����ȼ����![]()
�ô�������Ӧ��![]() ___
___![]() ���ú�a��b��c��ʽ�ӱ�ʾ����
���ú�a��b��c��ʽ�ӱ�ʾ����
��3���������ȼҵ�ĸ���Ʒ�����������ĵ缫��ӦʽΪ___��
��4�������������Ժϳɰ�����![]() ͨ��NaClO����Һ�п��Ի��
ͨ��NaClO����Һ�п��Ի��![]() д��
д��![]() �ĵ���ʽ__���÷�Ӧ�Ļ�ѧ����ʽΪ____��
�ĵ���ʽ__���÷�Ӧ�Ļ�ѧ����ʽΪ____��
��5��COҲ��һ����Ҫȼ�ϣ�������ȼ�տ�����Ƴ�����ȼ�ϵ�أ��õ���������ڵ�̼����Ϊ����ʣ���ȼ�ϵ�ظ����ĵ缫��ӦʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������ϢϢ��أ�����˵��������ǣ� ��
A. ��˿����Ҫ�ɷ��ǵ����ʣ�������Ȼ�߷��Ӳ���
B. �������Ƴ������羵�����������Ĵ�������Ҫ��ѧ�ɷ��ǹ�����
C. 2022�궬�»�۰����ٻ����������ǽ�������
D. ���й���ϵͳ�ƹ�����ȼ��ѹ����Ȼ����![]() ����Һ��ʯ������
����Һ��ʯ������![]() ������Ҫ�ɷֶ�����
������Ҫ�ɷֶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ƹ��Ĺ����ǣ����ճ�ɰ����Ҫ��HgS����������Ӧ��HgS+O2![]() Hg+SO2����ԭ���Ĺ�����̬��������Һ̬������������ͼ������˵������ȷ���ǣ� ��
Hg+SO2����ԭ���Ĺ�����̬��������Һ̬������������ͼ������˵������ȷ���ǣ� ��

A. �����������Բ��û���̿�����������������ŷ�
B. HgS+O2![]() Hg+SO2�÷�Ӧ��HgSֻ����ԭ��
Hg+SO2�÷�Ӧ��HgSֻ����ԭ��
C. ϴ�Ӵֹ�ʱ������5%���������5%������
D. �����м��������Ƶ�Ŀ���Ǽ���SO2���ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ������84����Һ��ͨ��ϡ��100��(���֮��)��ʹ�á���ش��������⣺
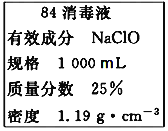
�ٸ���84����Һ�������ʵ���Ũ��ԼΪ___mol��L��1��������С�����һλ��
��ijͬѧȡ100mL����84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c(Na��)��___mol��L��1��
��2���ӿ���ѧ���ϲ�ã���������������ͭ��һ�������·�����Ӧ��14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4��
����2.5molFeS2�μӷ�Ӧʱ��������������ʵ���Ϊ__mol��ת�Ƶĵ���__mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Aֻ��C��H��O����Ԫ����ɣ��������л��ϳɵ��м��壬���8.4g���л��ᆳȼ������22.0g CO2��7.2gˮ������ͼ��������Է�������Ϊ84���������������A�к���-OH��λ�ڷ��Ӷ˵�-C��C-���˴Ź���������ʾ��3�ַ壬�����֮��Ϊ6:1:1��
��1��д��A�ķ���ʽ___________��
��2��д��A�Ľṹ��ʽ__________��
��3����������һ������A������Ӧ����_______������ţ���
A��H2 B��Na C��Br2 D��O2(Cu������)
�������Ĺؼ�����ΪA�ṹ��ȷ�����ڽ����2��ʱ�����õ�������е���Щ��ͼ��Ϣ_______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com