
【题目】有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-OH和位于分子端的-C≡C-,核磁共振氢谱显示有3种峰,峰面积之比为6:1:1。
(1)写出A的分子式___________;
(2)写出A的结构简式__________;
(3)下列物质一定能与A发生反应的是_______(填序号)。
A.H2 B.Na C.Br2 D.O2(Cu作催化剂)
解决该题的关键环节为A结构的确定,在解决(2)时,你用到了题干中的哪些谱图信息_______
【答案】C5H8O 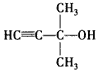 ABC 红外光谱和核磁共振氢谱
ABC 红外光谱和核磁共振氢谱
【解析】
(1)根据n=![]() 计算有机物A、二氧化碳、水的物质的量,根据原子守恒计算烃分子中C、H原子数目,根据相对原子质量计算分子中氧原子数目,据此判断该烃的分子式;
计算有机物A、二氧化碳、水的物质的量,根据原子守恒计算烃分子中C、H原子数目,根据相对原子质量计算分子中氧原子数目,据此判断该烃的分子式;
(2)红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6∶1∶1,分子中有3种不同的H原子,原子数目之比为6∶1∶1,结合有机物的分子式判断有机物A的结构;
(3)根据有机物A含有的官能团进行分析解答。
(1)有机物A只含有C、H、O三种元素,质谱图表明其相对分子质量为84,8.4g有机物A的物质的量=![]() =0.1mol,经燃烧生成22.0gCO2,物质的量为0.5mol,生成7.2gH2O,物质的量为
=0.1mol,经燃烧生成22.0gCO2,物质的量为0.5mol,生成7.2gH2O,物质的量为![]() =0.4mol,故有机物A分子中N(C)=5,N(H)=8,故N(O)=
=0.4mol,故有机物A分子中N(C)=5,N(H)=8,故N(O)=![]() =1,故A的分子式为C5H8O,故答案为:C5H8O;
=1,故A的分子式为C5H8O,故答案为:C5H8O;
(2)A的不饱和度为:![]() =2,红外光谱分析表明A分子中含有-OH键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6∶1∶1,故分子中含有2个CH3、1个-OH连接在同一C原子上,所以A的结构简式为:
=2,红外光谱分析表明A分子中含有-OH键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6∶1∶1,故分子中含有2个CH3、1个-OH连接在同一C原子上,所以A的结构简式为: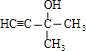 ,故答案为:
,故答案为: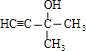 ;
;
(3)红外光谱分析表明A分子中含有-OH键和位于分子端的C≡C键,不饱和度为![]() =2,不含其它官能团,含有羟基,能与钠反应,含有C≡C键,能与溴发生加成反应,能与氢气发生加成反应,与羟基相连碳原子的邻位碳原子上没有氢原子,不能发生催化氧化,故答案为:ABC;
=2,不含其它官能团,含有羟基,能与钠反应,含有C≡C键,能与溴发生加成反应,能与氢气发生加成反应,与羟基相连碳原子的邻位碳原子上没有氢原子,不能发生催化氧化,故答案为:ABC;
根据上述解析,解决该题的关键环节为A结构的确定,在解决(2)时,用到了题干中的红外光谱和核磁共振氢谱的谱图信息,故答案为:红外光谱和核磁共振氢谱。


科目:高中化学 来源: 题型:
【题目】Ⅰ.碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是____;氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是____。
(2)若采用下图实验装置将四氯化碳和I2的混合溶液分离。
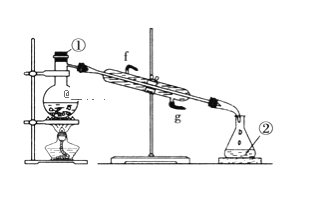
写出图中仪器的名称:①____;该装置还缺少的仪器是__;冷凝管的进水口是:__(填g或f)。
Ⅱ.我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸密度为1.19 g/cm3配制成250mL 0.1mol·L-1的盐酸溶液。
(1)配制上述溶液除250mL容量瓶、烧杯、胶头滴管、量筒外还需要的玻璃仪器是___。
(2)根据计算,需要36.5%的浓盐酸的体积为______mL。
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)_______。
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)假设配制时其他操作均正确,只出现以下哪种情况时,会造成所配制的溶液浓度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸馏水
B.定容时仰视容量瓶读数
C.定容时俯视容量瓶读数
D.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 25℃时,加水稀释0.1mol/LNH4Cl,溶液中![]() 增大
增大
B. 反应2NO+O2=2NO2常温下可自发进行,该反应为吸热反应
C. 用NaOH标准溶液滴定未知浓度的CH3COOH溶液时,使用酚酞作指示剂
D. 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为![]() 、
、![]() 和
和![]() 。
。
(1)![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置____。
在元素周期表中的位置____。
其中铜、硒、碲的主要回收流程如图:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。
①写出![]() 硫酸化焙烧的化学方程式____。
硫酸化焙烧的化学方程式____。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___。
③滤液2经过____、_____、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____(填序号)。

a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了
浓度的增加,促进了![]() 的沉积。写出
的沉积。写出![]() 的沉积的电极反应式为____。
的沉积的电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。
已知:①氯气与碱反应放出热量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
试回答下列问题:
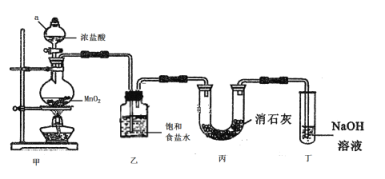
(1)甲装置中仪器a的名称是________________________。
(2)装置乙中饱和食盐水的作用是________________________。
(3)装置丁中发生反应的化学方程式为_____________________。
(4)漂白粉在空气中失效的原因是______________、______________(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是________ 。
②为提高Ca(ClO)2的含量。可采取的措施是___________(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,如图是它的一种合成路线(具体反应条件和部分试剂略)

已知:
①氯化亚砜![]() 可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② +X2
+X2 +HX(X表示卤素原子)
+HX(X表示卤素原子)
③![]()
回答下列问题:
(1)F中所含的官能团名称是_______。
(2)![]() 的反应类型是______。
的反应类型是______。
(3)写出F和C在浓硫酸条件下反应的化学方程式______。
(4)写出A的符合以下条件同分异构体的所有结构简式_______。
①属于苯的二取代物; ②苯环上的一氯代物有2种; ③与![]() 溶液发生显色反应。
溶液发生显色反应。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线,并注明反应条件____。
)写出合成路线,并注明反应条件____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。

(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。完成下列填空:
(1)画出磷的原子结构示意图________。
(2)磷酸钙真空制磷的反应为![]() 。该反应的氧化产物是________(填化学式);
。该反应的氧化产物是________(填化学式);![]() 中的共价键的类型为________。
中的共价键的类型为________。
(3)次磷酸钠的结构为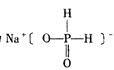 。
。
①次磷酸钠的化学式为________,磷的化合价为________。
②次磷酸钠为________盐(填“正”“酸式”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com