
【题目】磷的单质及其化合物用途非常广泛。完成下列填空:
(1)画出磷的原子结构示意图________。
(2)磷酸钙真空制磷的反应为![]() 。该反应的氧化产物是________(填化学式);
。该反应的氧化产物是________(填化学式);![]() 中的共价键的类型为________。
中的共价键的类型为________。
(3)次磷酸钠的结构为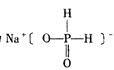 。
。
①次磷酸钠的化学式为________,磷的化合价为________。
②次磷酸钠为________盐(填“正”“酸式”)。
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-OH和位于分子端的-C≡C-,核磁共振氢谱显示有3种峰,峰面积之比为6:1:1。
(1)写出A的分子式___________;
(2)写出A的结构简式__________;
(3)下列物质一定能与A发生反应的是_______(填序号)。
A.H2 B.Na C.Br2 D.O2(Cu作催化剂)
解决该题的关键环节为A结构的确定,在解决(2)时,你用到了题干中的哪些谱图信息_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有大量的下列离子:Fe3+、NO3—、K+和M离子,经测定Fe3+、NO3—、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用双线桥标出电出电子转移的方向与数目______________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式: ![]() ____、____、____、____、____、___、
____、____、____、____、____、___、
(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:![]()
①该反应的氧化剂是____________氧化产物与还原产物的物质的量比是 __________
②如果反应生成0.3mol的单质碘,则转移的电子数目是_____________
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室模拟反应![]() 制备重要的化工原料
制备重要的化工原料![]() 。
。
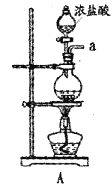
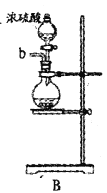
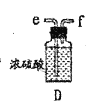
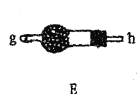
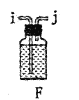
已知:![]() 熔点-93.6℃,沸点76.1℃,遇水极易水解,易与
熔点-93.6℃,沸点76.1℃,遇水极易水解,易与![]() 反应;
反应;![]() 熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于
熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于![]() 。
。
(1)装置A中发生反应的离子方程式是__________________。
(2)以上各仪器接口的连接顺序是a→____→____→____→____→cd←g←h←b,装置E中的试剂为无水氯化钙,F中所装的试剂是________。(仪器不重复使用)
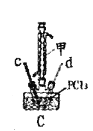
(3)装置C制备![]() 。
。
①仪器甲的名称是_______。
②反应温度控制在60~65℃,其原因是______________。
③![]() 发生水解反应生成
发生水解反应生成![]() 和_____________。
和_____________。
(4)该装置不足之处是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2O b.CH3COONa c.NH4Cl d.NaHSO4常温下呈酸性的有_________(填序号)。
(2)已知25℃ 时,醋酸的Ka=1.8×10-5 ,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11。有①NaHCO3溶液,②CH3COONa溶液,③NaOH溶液各25 mL,浓度均为0.1mol/L三种溶液的pH由大到小顺序为______________(请序号);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:_________________、_________________,该溶液中的离子浓度由大到小的顺序是: __________________。
(3)有浓度均为0.1 mol/L的 ①盐酸 ②硫酸 ③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为____________________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积大小关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)______mol CO2 中含有氧原子数跟 1.806×1024 个 H2O 分子含有的氧原子数相同。
(2)标准状况下的甲烷和一氧化碳的混合气体 8.96 L,其质量为 7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(3)等物质的量 O2 和臭氧(O3),其质量之比为____。若 O2 和 O3 质量相等,则其原子数之比为____。
(4)200 毫升含 MgCl2、KCl、Na2SO4 三种溶质的混合液中,已知其中含 Cl-1.5 mol,K+和 Na+共1.5 mol,Mg2+为 0.5 mol,则 SO42-的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地区的雾霾中可能含有下列可溶性离子:Na+、Ba2+、Mg2+、Fe3+、SO42-、Cl-、CO32-。某学习小组收集了该地区的雾霾,经必要的预处理后配成试样溶液,并完成了如下实验:①取试样溶液100mL,加入足量BaCl2溶液,得到白色沉淀2.33g。②另取试样溶液100mL,加入足量NaOH溶液,得到白色沉淀1.16g。根据实验结果下列说法正确的是
A.该雾霾肯定不含Ba2+、Fe3+,可能含有CO32-
B.该雾霾肯定含有Mg2+、SO42-、Cl-,可能含有Na+
C.试样溶液中SO42-的物质的量浓度为0.01 mol/L
D.向实验①和②所得白色沉淀中加入盐酸,沉淀均可溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com