
【题目】(1)______mol CO2 中含有氧原子数跟 1.806×1024 个 H2O 分子含有的氧原子数相同。
(2)标准状况下的甲烷和一氧化碳的混合气体 8.96 L,其质量为 7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(3)等物质的量 O2 和臭氧(O3),其质量之比为____。若 O2 和 O3 质量相等,则其原子数之比为____。
(4)200 毫升含 MgCl2、KCl、Na2SO4 三种溶质的混合液中,已知其中含 Cl-1.5 mol,K+和 Na+共1.5 mol,Mg2+为 0.5 mol,则 SO42-的物质的量浓度为__________________。
【答案】1.5 6.72L 2.8g 2:3 1:1 2.5mol/L
【解析】
:(1)要使二氧化碳分子、水分子含有氧原子个数相等,则二者含有氧原子物质的量相等,应满足:n(CO2)×2=![]() ×1,解得n(CO2)=1.5mol,故答案为:1.5;
×1,解得n(CO2)=1.5mol,故答案为:1.5;
(2)设CH4为x,CO为y,则x+y=![]() 、16x+28y=7.60g,解得:x=0.3,y=0.1,即CH4为0.3 mol,CO为0.1mol,则甲烷体积为:0.3mol×22.4L/mol=6.72 L; CO质量为:0.1mol×28g/mol=2.8 g,故答案为:6.72L;2.8g;
、16x+28y=7.60g,解得:x=0.3,y=0.1,即CH4为0.3 mol,CO为0.1mol,则甲烷体积为:0.3mol×22.4L/mol=6.72 L; CO质量为:0.1mol×28g/mol=2.8 g,故答案为:6.72L;2.8g;
(3)依据m=nM可知,二者质量之比等于二者相对分子质量之比,所以等物质的量O2和臭氧(O3),其质量之比为:32:48=2:3;若O2和O3质量相等,其原子数之比为:![]() ×2×NA:
×2×NA:![]() ×3×NA=1:1;故答案为:2:31:1;
×3×NA=1:1;故答案为:2:31:1;
(4)溶液呈电中性,由电荷守恒可知:n(Cl-)+2n(SO42-)=n(K+)+n(Na+)+2n(Mg2+),即:1.5mol+2n(SO42-)=1.5mol+2×0.5mol,解得n(SO42-)=0.5mol,c(SO42-)=![]() =2.5mol/L,故答案为:2.5mol/L。
=2.5mol/L,故答案为:2.5mol/L。


科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。

(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。完成下列填空:
(1)画出磷的原子结构示意图________。
(2)磷酸钙真空制磷的反应为![]() 。该反应的氧化产物是________(填化学式);
。该反应的氧化产物是________(填化学式);![]() 中的共价键的类型为________。
中的共价键的类型为________。
(3)次磷酸钠的结构为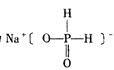 。
。
①次磷酸钠的化学式为________,磷的化合价为________。
②次磷酸钠为________盐(填“正”“酸式”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对全球近期的气候异常,环境问题再次成为焦点。SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g) ΔH3=-Q3 kJ/mol
则23g液态酒精完全燃烧并恢复至室温放出的热量为________________kJ。
(2)下表为反应2SO2(g)+O2 (g)![]() 2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)①已知:在2L密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)![]() N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.040mol/L,c(N2O4)=0.0070mol/L,则改变的条件是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
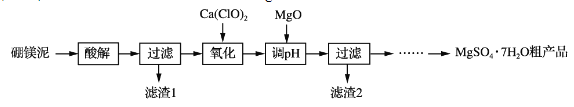
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有抗疟药理活性的喹啉类衍生物,其合成路线流程图如下:

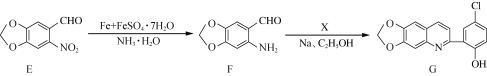
已知:
(1) F中的含氧官能团名称为________、________。
(2) B→C的反应类型为________。
(3)芳香族化合物X的分子式为C8H7ClO2,写出X的结构简式:___________________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________________________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、![]() 、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )

A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,还原产物是![]()
C. 配平后氧化剂与还原剂的化学计量数之比为4∶1
D. ClO-发生还原反应,表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能实现相应实验目的的是

A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共0.1 mol,完全燃烧得0.16 mol二氧化碳和3.6 g水。下列说法正确的是( )
A. 一定有甲烷 B. 一定是甲烷和乙烯 C. 可能有乙烷 D. 一定有乙炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com