
【题目】面对全球近期的气候异常,环境问题再次成为焦点。SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g) ΔH3=-Q3 kJ/mol
则23g液态酒精完全燃烧并恢复至室温放出的热量为________________kJ。
(2)下表为反应2SO2(g)+O2 (g)![]() 2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)①已知:在2L密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)![]() N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.040mol/L,c(N2O4)=0.0070mol/L,则改变的条件是______________。
【答案】![]() (Q3-Q2+3Q1) < 0.012 mol/L 升高温度
(Q3-Q2+3Q1) < 0.012 mol/L 升高温度
【解析】
(1)依据盖斯定律得出液体乙醇完全燃烧产生液体水的热化学方程式,再计算23g乙醇燃烧放出的热量;
(2)化学平衡常数只与温度有关,根据温度与化学平衡常数的变化关系判断反应的热效应;
(3)①根据平衡常数的含义结合平衡时c(NO2),可计算出平衡时c(N2O4);
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)、c(N2O4),求出K值,K值减小,说明升高了温度,平衡逆向移动。
(1)①H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
②C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
③-②+①×3整理可得C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-(Q3-Q2+3Q1) kJ/mol
23g酒精的物质的量是0.5mol,则其完全燃烧产生液体水放出热量Q=![]() (Q3-Q2+3Q1) kJ;
(Q3-Q2+3Q1) kJ;
(2)根据表格数据可知,温度升高,K减小,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向为吸热反应,则该反应的正反应为放热反应,所以ΔH<0;
(3)①平衡时n(NO2)=0.060mol,容器的容积为2L,所以平衡时NO2的浓度为c(NO2)=0.060mol÷2L=0.030mol/L,根据2NO2(g)![]() N2O4(g)的化学平衡常数K=
N2O4(g)的化学平衡常数K=![]() =13.3,c(N2O4)=K×c2(NO2)= 0.012mol/L;
=13.3,c(N2O4)=K×c2(NO2)= 0.012mol/L;
②改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.040mol/L,c(N2O4)=0.0070mol/L,K=![]() <13.3,K减小,说明升高了温度,平衡逆向移动,导致化学平衡常数减小。
<13.3,K减小,说明升高了温度,平衡逆向移动,导致化学平衡常数减小。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有大量的下列离子:Fe3+、NO3—、K+和M离子,经测定Fe3+、NO3—、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
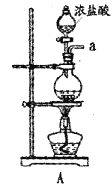
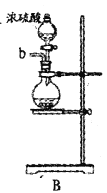
【题目】某兴趣小组在实验室模拟反应![]() 制备重要的化工原料
制备重要的化工原料![]() 。
。
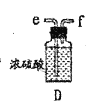
已知:![]() 熔点-93.6℃,沸点76.1℃,遇水极易水解,易与
熔点-93.6℃,沸点76.1℃,遇水极易水解,易与![]() 反应;
反应;![]() 熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于
熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于![]() 。
。
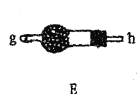
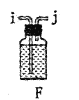
(1)装置A中发生反应的离子方程式是__________________。
(2)以上各仪器接口的连接顺序是a→____→____→____→____→cd←g←h←b,装置E中的试剂为无水氯化钙,F中所装的试剂是________。(仪器不重复使用)
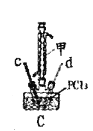
(3)装置C制备![]() 。
。
①仪器甲的名称是_______。
②反应温度控制在60~65℃,其原因是______________。
③![]() 发生水解反应生成
发生水解反应生成![]() 和_____________。
和_____________。
(4)该装置不足之处是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2O b.CH3COONa c.NH4Cl d.NaHSO4常温下呈酸性的有_________(填序号)。
(2)已知25℃ 时,醋酸的Ka=1.8×10-5 ,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11。有①NaHCO3溶液,②CH3COONa溶液,③NaOH溶液各25 mL,浓度均为0.1mol/L三种溶液的pH由大到小顺序为______________(请序号);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:_________________、_________________,该溶液中的离子浓度由大到小的顺序是: __________________。
(3)有浓度均为0.1 mol/L的 ①盐酸 ②硫酸 ③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为____________________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积大小关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的 CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐![]() 滤液
滤液![]() 滤液
滤液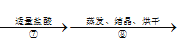 精盐,下列说法不正确的是
精盐,下列说法不正确的是
A.第②步过滤出的滤渣是泥沙
B.在第④步中不能用 KOH 替代 NaOH
C.第⑤步加入 Na2CO3 溶液的目的是除去 Ba2+
D.第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、BaCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)______mol CO2 中含有氧原子数跟 1.806×1024 个 H2O 分子含有的氧原子数相同。
(2)标准状况下的甲烷和一氧化碳的混合气体 8.96 L,其质量为 7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(3)等物质的量 O2 和臭氧(O3),其质量之比为____。若 O2 和 O3 质量相等,则其原子数之比为____。
(4)200 毫升含 MgCl2、KCl、Na2SO4 三种溶质的混合液中,已知其中含 Cl-1.5 mol,K+和 Na+共1.5 mol,Mg2+为 0.5 mol,则 SO42-的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系 如图所示,下列说法中不正确的是( )

A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7与FeSO4开始反应时物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。己知NaNO2和HI能发生如下反应:______NaNO2 +_______HI →_________NO↑+_____ I2 + _________NaI +_____
(1)请将生成物补充完整并配平,并用单线桥法标出电子转移的方向和数目。___________
(2)上述反应中氧化剂与还原剂的物质的量之比为_________,若标准状况下生成3.36L NO,则反应中转移电子的数目是______________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒⑤食醋,进行实验选用物质合适的是______(填字母编号)。
A.①③ ⑤ B.①② ④ C.①②⑤ D.②④⑤
(4)某工厂废液中,含有2%—5%的NaNO2,直接排放会造成污染,采用NH4Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______________。
(5)把氯气通到NaNO2溶液中,生成NaNO3和HCl,写出反应的离子方程式:______。
(6)亚硝酸盐可将正常的携氧亚铁血红蛋白转化成三价铁血红蛋白,失去携氧能力,引起组织缺氧导致中毒。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中不正确的是_______。
A.在中毒过程中携氧亚铁血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时三价铁血红蛋白被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com