
【题目】水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2O b.CH3COONa c.NH4Cl d.NaHSO4常温下呈酸性的有_________(填序号)。
(2)已知25℃ 时,醋酸的Ka=1.8×10-5 ,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11。有①NaHCO3溶液,②CH3COONa溶液,③NaOH溶液各25 mL,浓度均为0.1mol/L三种溶液的pH由大到小顺序为______________(请序号);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:_________________、_________________,该溶液中的离子浓度由大到小的顺序是: __________________。
(3)有浓度均为0.1 mol/L的 ①盐酸 ②硫酸 ③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为____________________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积大小关系为________________。
【答案】cd ③①② HCO3-![]() H++CO32- HCO3-+H2O
H++CO32- HCO3-+H2O![]() H2CO3+OH- c(Na+)>c(HCO3-)> c(OH-)>c(H+)>c(CO32-) ③>①>② ②<③=①
H2CO3+OH- c(Na+)>c(HCO3-)> c(OH-)>c(H+)>c(CO32-) ③>①>② ②<③=①
【解析】
(1)弱酸根离子水解显酸性,电离出氢离子的物质其水溶液显酸性;
(2)Ka越大,酸性越强,其对应盐的水解程度越小;NaHCO3溶液中HCO3-存在电离平衡和水解平衡,HCO3-水解程度大于电离程度而使溶液呈碱性,溶液中存在电荷守恒,无论电离程度还是水解程度都较小;
(3)氢离子浓度越大,酸性越强,其pH越小,氢离子浓度越小,消耗碱的量越少。
(1) a.NH3·H2O是一元弱碱,在溶液中存在电离平衡:NH3·H2O![]() NH4++OH-,最终达到平衡时,溶液中c(OH-)>c(H+) ,溶液显碱性,a错误;
NH4++OH-,最终达到平衡时,溶液中c(OH-)>c(H+) ,溶液显碱性,a错误;
b.CH3COONa是强碱弱酸盐,在溶液中CH3COO-发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,水进一步发生电离作用,最终达到平衡时,溶液中c(OH-)>c(H+),溶液显碱性,b错误;
c.NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应,消耗水电离产生的OH-,破坏了水的电离平衡,水进一步发生电离作用,最终达到平衡时,溶液中c(H+)>c(OH-) ,溶液显酸性,c正确;
d.NaHSO4强酸的酸式盐,在水中NaHSO4完全电离出氢离子而使溶液呈强酸性,d正确;
所以呈酸性的溶液是氯化铵和硫酸氢钠,合理选项是cd;
(2)Ka越大,酸性越强,其对应盐的水解程度越小,等浓度的盐溶液的碱性就越小,由于醋酸的电离平衡常数大于碳酸的第一步电离平衡常数,所以浓度均为0.1mol/L三种溶液,溶液的碱性NaHCO3溶液大于CH3COONa溶液;即pH:①>②,但盐的水解程度是微弱的,盐水解产生的OH-小于等浓度的一元强碱电离产生的OH-的浓度,因此pH最大的为NaOH溶液,所以pH由大到小顺序为③①②;
NaHCO3溶液中HCO3-存在电离平衡和水解平衡,方程式分别为:HCO3-![]() H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O![]() H2CO3+OH-;HCO3-无论是发生电离还是发生水解都会使碳酸氢根离子浓度减小,而钠离子不水解,碳酸氢根离子水解,所以c(Na+)>c(HCO3-),溶液显碱性,说明HCO3-水解程度大于HCO3-的电离程度而使溶液呈碱性,所以c(OH-)>c(H+),但水解是微弱的,溶液中阴离子主要以HCO3-存在,所以c(HCO3-)> c(OH-),溶液中碳酸氢根离子电离出氢离子和碳酸根离子、水电离出氢离子,所以c(H+)>c(CO32-),故溶液中各种离子浓度大小顺序是c(Na+)>c(HCO3-)> c(OH-)>c(H+)> c(CO32-);
H2CO3+OH-;HCO3-无论是发生电离还是发生水解都会使碳酸氢根离子浓度减小,而钠离子不水解,碳酸氢根离子水解,所以c(Na+)>c(HCO3-),溶液显碱性,说明HCO3-水解程度大于HCO3-的电离程度而使溶液呈碱性,所以c(OH-)>c(H+),但水解是微弱的,溶液中阴离子主要以HCO3-存在,所以c(HCO3-)> c(OH-),溶液中碳酸氢根离子电离出氢离子和碳酸根离子、水电离出氢离子,所以c(H+)>c(CO32-),故溶液中各种离子浓度大小顺序是c(Na+)>c(HCO3-)> c(OH-)>c(H+)> c(CO32-);
(3)硫酸为二元强酸,盐酸为一元强酸,醋酸为一元弱酸,等浓度时硫酸中氢离子浓度最大,醋酸中氢离子浓度最小,溶液中氢离子浓度越大,溶液的pH就越小,所以三种溶液的pH由大到小的顺序为③>①>②;
氢离子浓度越小,消耗碱的量越少,即氢离子浓度越小,中和一定量NaOH溶液生成正盐时,消耗酸的体积越大,所以消耗三种酸的体积有小到大的为②<③=①。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,如图是它的一种合成路线(具体反应条件和部分试剂略)

已知:
①氯化亚砜![]() 可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② +X2
+X2 +HX(X表示卤素原子)
+HX(X表示卤素原子)
③![]()
回答下列问题:
(1)F中所含的官能团名称是_______。
(2)![]() 的反应类型是______。
的反应类型是______。
(3)写出F和C在浓硫酸条件下反应的化学方程式______。
(4)写出A的符合以下条件同分异构体的所有结构简式_______。
①属于苯的二取代物; ②苯环上的一氯代物有2种; ③与![]() 溶液发生显色反应。
溶液发生显色反应。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线,并注明反应条件____。
)写出合成路线,并注明反应条件____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图表示的一些物质或概念间的从属关系中不正确的是

X | Y | Z | |
A | 酸 | 电解质 | 化合物 |
B | 酸式盐 | 盐 | 化合物 |
C | 溶液 | 分散系 | 物质 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。完成下列填空:
(1)画出磷的原子结构示意图________。
(2)磷酸钙真空制磷的反应为![]() 。该反应的氧化产物是________(填化学式);
。该反应的氧化产物是________(填化学式);![]() 中的共价键的类型为________。
中的共价键的类型为________。
(3)次磷酸钠的结构为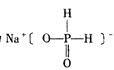 。
。
①次磷酸钠的化学式为________,磷的化合价为________。
②次磷酸钠为________盐(填“正”“酸式”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种难溶银盐的Ksp与颜色如右表,下列说法正确的是
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对全球近期的气候异常,环境问题再次成为焦点。SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g) ΔH3=-Q3 kJ/mol
则23g液态酒精完全燃烧并恢复至室温放出的热量为________________kJ。
(2)下表为反应2SO2(g)+O2 (g)![]() 2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)①已知:在2L密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)![]() N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.040mol/L,c(N2O4)=0.0070mol/L,则改变的条件是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
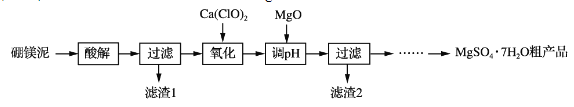
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、![]() 、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )

A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,还原产物是![]()
C. 配平后氧化剂与还原剂的化学计量数之比为4∶1
D. ClO-发生还原反应,表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:
化学键 | C-H | C=O | N-H | C-N | H-O |
键能(kJ/mol) | a | b | c | d | e |
甲醛制备乌洛托品的反应如下,6![]() (g) + 4NH3(g) →
(g) + 4NH3(g) →  + 6H2O(l)
+ 6H2O(l)
该反应的⊿H为 ( )
A. 6(a+b+c-d-e)kJ/molB. 6(d+e-a-b-c)kJ/mol
C. 6(b+2c-2d-2e)kJ/molD. 6(2d+2a+2e-b-3c)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com