
【题目】(1)写出下列基团(或官能团)的名称或结构简式:
﹣CH2CH3_______、﹣Br_______、碳碳三键 _______
(2)乙烯的空间构型 _______
(3)乙炔的电子式_______
(4)苯的同系物的通式_______
(5)![]() 分子式:_______
分子式:_______
(6)![]() 其苯环上的一氯代物有_______ 种
其苯环上的一氯代物有_______ 种
(7)2,5﹣二甲基﹣4﹣乙基庚烷(写出结构简式) _______
(8)4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) _______
(9)![]() 的系统命名是_______
的系统命名是_______
(10)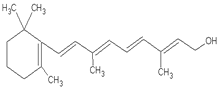 1mol该物质消耗_______molH2,_______molBr2 _______molNa
1mol该物质消耗_______molH2,_______molBr2 _______molNa
(11)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_____;
(12)写出C5H8属于炔烃的所有同分异构体__________.
【答案】乙基 溴原子 ﹣C≡C﹣ 平面结构 ![]() CnH2n﹣6(n≥6的整数) C12H10 5 (CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3 CH3C≡C﹣C(CH3)2CH(CH3)2 2,6﹣二甲基辛烷 5 5 1 浓溴水 CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2
CnH2n﹣6(n≥6的整数) C12H10 5 (CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3 CH3C≡C﹣C(CH3)2CH(CH3)2 2,6﹣二甲基辛烷 5 5 1 浓溴水 CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2
【解析】
(1)熟悉常见原子团的书写方法以及常见官能团的结构简式和名称即可轻松解答;
乙烯是空间平面结构的分子;
(3)根据化学键类型及原子间形成共用电子对数目解答;
(4)苯的同系物的通式CnH2n﹣6(n≥6的整数);
(5)根据结构简式结合碳原子的成键特点书写分子式;
(6)有机物中的等效氢原子有几种,其一氯代物就有几种;
(7)(9)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;据此回答;
(8)根据炔烃的命名原则写出4,4,5﹣三甲基﹣2﹣己炔的结构简式;
(10)有机物中的双键可以被氢气以及溴单质加成,其中的羟基可以和金属钠之间反应;
(11)苯不溶于水,密度比水小,可以萃取溴水中的溴,溶液分层,有机层在上方;碘化钾与溴水发生氧化还原反应生成单质碘;硝酸银与溴水反应生成浅黄色沉淀;己烯与溴发生加成反应,溴水颜色褪去;四氯化碳不溶于水,但密度比水大,可以萃取溴水中的溴,溶液分层,有机层在下层,可用浓溴水鉴别有机物;
(12)分子式为C5H8的炔烃有官能团位置异构、碳链异构。
(1)﹣CH2CH3为乙基,﹣Br为卤素中的溴原子;碳碳三键﹣C≡C﹣,
故答案为:乙基;溴原子;﹣C≡C﹣;
乙烯是空间平面结构的分子,
故答案为:平面结构;
(3)乙炔中碳原子最外层有4个电子,要达到稳定结构要形成四对共用电子对,而1个氢原子只能与1个碳原子形成形成1对公用电子对,所以碳原子和碳原子间只能形成3对公用电子对,所以乙炔的电子式为![]() ,
,
故答案为:![]() ;
;
(4)苯的同系物的通式CnH2n﹣6(n≥6的整数),
故答案为:CnH2n﹣6(n≥6的整数);
(5)![]() 分子式是C12H10,
分子式是C12H10,
故答案为:C12H10;
(6)![]() 中存在5中等效氢原子,所以 其苯环上的一氯代物有5种,
中存在5中等效氢原子,所以 其苯环上的一氯代物有5种,
故答案为:5;
(7)2,5﹣二甲基﹣4﹣乙基庚烷,最长的主链含有7个C原子,甲基处于2、5号碳原子上,乙基处于4号碳原子上,其结构简式为:CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3,故答案为:(CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3.
(8)4,4,5﹣三甲基﹣2﹣己炔,该有机物主链为己炔,碳碳三键在2号C,在4、4、5号C原则各含有1个甲基,该有机物的结构简式为:CH3C≡C﹣C(CH3)2CH(CH3)2,故答案为:CH3C≡C﹣C(CH3)2CH(CH3)2;
(9)![]() 的主链碳原子数数目是8个,为辛烷,在2、6号碳原子上有甲基,名称为:2,6﹣二甲基辛烷,
的主链碳原子数数目是8个,为辛烷,在2、6号碳原子上有甲基,名称为:2,6﹣二甲基辛烷,
故答案为:2,6﹣二甲基辛烷;
(10)有机物中的双键5mol可以被氢气以及溴单质加成,分别消耗氢气和溴单质是5mol,其中的羟基1mol可以和1mol金属钠之间反应,
故答案为:5;5;1;
(11)苯不溶于水,密度比水小,可以萃取溴水中的溴,溶液分层,层由无色变为橙红色,下层由橙色变为无色,碘化钾与溴水发生氧化还原反应生成单质碘,溶液颜色由无色变为黄色,硝酸银与溴水反应生成浅黄色沉淀,己烯与溴发生加成反应,溶液分层,上,下两层均变为无色,四氯化碳不溶于水,但密度比水大,可以萃取溴水中的溴,溶液分层,上层由橙色变为无色,下层由无色变为橙红色,所以可以用溴水来进行鉴别,
故答案为:浓溴水;
(12)分子式为C5H8的炔烃,可能的结构简式有:CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2,
故答案为:CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2。


科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
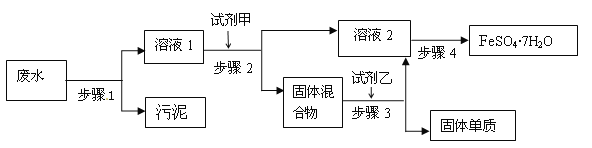
(1)步骤1的主要操作是___,需用到的玻璃仪器除烧杯外还有___。
(2)固体混合物是____(填化学式)
(3)步骤3中发生反应的化学方程式为___。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、干燥。
(5)火法制得的粗铜中常混有少量氧化亚铜(Cu2O),氧化亚铜溶于稀硫酸溶液变蓝。试写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
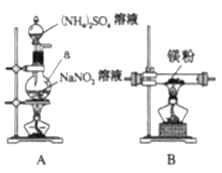
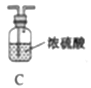

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上被称为“世界八大公害”和“20 世纪十大环境公害”之一的洛杉矶光化学烟雾事件使 人们深刻认识到了汽车尾气的危害性。汽车尾气中氮氧化物和碳氢化合物受紫外线作用可产 生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )
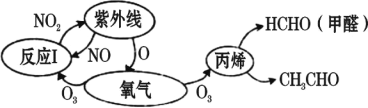
A.烟雾是一种固溶胶,其分散剂是空气B.O2 和 O3 是氧的两种同素异形体
C.反应 I 属于氧化还原反应D.NO2 不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84 消毒液”能有效杀灭甲型 H1N1 病毒,某同学购买了一瓶“威露士”牌“84 消毒液”,该消毒液通常稀释 100 倍(体积比)使用。查阅相关资料和消毒液包装说明得到 如下信息:
① ②NaClO = Na++ClO-
②NaClO = Na++ClO-
(1)该“84 消毒液”的物质的量浓度约为_____(保留 1 位小数)。
(2)某同学取 100mL 该“84 消毒液”,按要求稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 480mL 含 NaClO 质量分数为25%的消毒液。下列说法不正确的是____________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 149.0g
(4)该同学对容量瓶及其使用方法的认识中正确的是_____(填字母)。
A.容量瓶上标有容积、温度和浓度 B.使用前要检查容量瓶是否漏液 C.容量瓶用蒸馏水洗净后,须烘干后再使用 D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)一瓶上述“威露士”牌“84 消毒液”能吸收空气中_____L 的 CO2(标准状况)而变质。(已 知:CO2+NaClO+H2O=NaHCO3+HClO)
(6)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1 的浓 硫酸配制 500 mL2.3 molL﹣1 的稀硫酸用于增强“84 消毒液”的消毒能力,需取用浓硫酸的体 积为______________mL。
(7)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_____(填代号)。
①用量筒量取 98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的 H2SO4 溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
(8)现有密度为 d g/mL 浓度为 18 mol/L 的浓硫酸溶液 100 g ,需要加入一定量的水将其 稀释为浓度是 9 mol/L,则加入水的体积是_____(填字母)
A.大于 100 mL B.小于 l00 mL C.等于 100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量为 3.9 g 的 Na2X 中含有 Na+的物质的量为 0.1mol,则 Na2X 的摩尔质 量为_____。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,R 的相对原子质量为________。
(3)3.01×1022 个 S2- 含有电子的物质的量为_____________。
(4)0.3NA 个硫酸分子与____________ g 磷酸(H3PO4)含有相同的氧原子数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)15.8gKMnO4的物质的量是___,所含原子数目为___,其所含氧元素与___molNaClO中所含氧元素的质量相同。
(2)相同条件下,相同质量的Al(OH)3和Na2O2中氧原子的个数比是___;相同物质的量的NH4+与OH-所含电子个数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的 CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐![]() 滤液
滤液![]() 滤液
滤液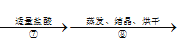 精盐,下列说法不正确的是
精盐,下列说法不正确的是
A.第②步过滤出的滤渣是泥沙
B.在第④步中不能用 KOH 替代 NaOH
C.第⑤步加入 Na2CO3 溶液的目的是除去 Ba2+
D.第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、BaCl2、Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com