
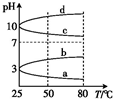
 NH4Al(SO4)2是加工食品最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业有广泛应用.试回答下列问题:
NH4Al(SO4)2是加工食品最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业有广泛应用.试回答下列问题:

科目:高中化学 来源: 题型:
| A、步骤①中的白色沉淀为2种钡盐 |
| B、溶液中难以确定Cl-的存在与否 |
| C、原溶液中所含的离子有5种 |
| D、步骤③中可以确定Fe2+、NO3-的存在,不能确定其它离子是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2FeO4在溶液中显强酸性,能消毒杀菌 |
| B、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
| C、Na2FeO4的还原产物Fe3+易水解为Fe(OH)3胶体,可使水中悬浮物凝聚沉降 |
| D、Na2FeO4的还原产物Fe2+易水解为Fe(OH)2胶体,可使水中悬浮物凝聚沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能发生消去反应 |
| B、能发生取代反应 |
| C、能溶于水 |
| D、不能氧化为醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
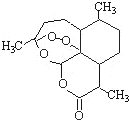 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.至今已被多个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.至今已被多个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A、分子式为:C15H24O5 |
| B、该化合物在一定条件下不能与NaOH溶液反应 |
| C、该化合物中含有过氧键,一定条件下有氧化性 |
| D、青蒿素与维生素一样是水溶性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行分液操作时,分液漏斗中下层液体从下口放出 上层液体从上口倒出 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、进行分液操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| D、进行蒸发操作时,不能使混合物中的水分完全蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X3YZ3 |
| B、X2YZ2 |
| C、XYZ2 |
| D、XYZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价化合物中一定只含有极性共价键 |
| B、只含有共价键的物质一定是共价化合物 |
| C、离子化合物中可能含有极性共价键或非极性共价键 |
| D、有较强共价键存在的物质熔沸点一定很高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com