
【题目】下列实验操作或事实与预期实验目的或所得结论对应错误的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | CaO | 实验室用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中可能含有H2SO3 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.
测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度.
实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
实验装置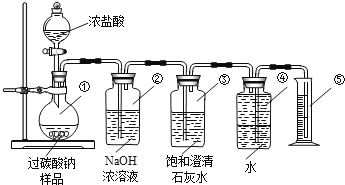
交流与讨论
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度.
(1)装置②的作用是:;
(2)装置③的作用是:;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于g;
(4)Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度.但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是();(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
(5)Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g.则该样品的纯度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在澄清透明溶液中,下列离子组能大量共存的是( )
A. Ca2+、Na+、SO42-、Cl- B. Mg2+、Cu2+、SO42-、NO3-
C. NH4+、K+、OH-、Cl- D. OH-、HCO3-、NO3-、、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图: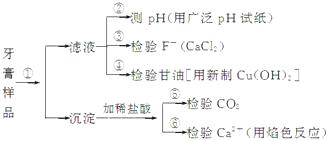
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 , 所需要的主要玻璃仪器有。
(2)在②中用pH试纸测溶液的pH的操作方法是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ca2+、Ba2+、NH4+等离子。进行了下述实验(所加酸、碱、氨水、溴水都是过量的)。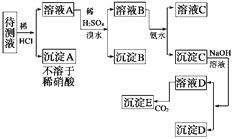
根据实验回答下列问题:
(1)判定待测液中有无Ba2+、Ca2+ , 并写出理由。
(2)写出沉淀D的化学式:。
(3)写出从溶液D生成沉淀E的反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是( )
A.NH ![]() 、NO
、NO ![]() 、CO
、CO ![]() 、Na +
、Na +
B.Na+、Ba2+、Mg2+、HCO ![]()
C.NO ![]() 、K+、[Al(OH)4]﹣、OH﹣
、K+、[Al(OH)4]﹣、OH﹣
D.NO ![]() 、Mg2+、K+、Cl﹣
、Mg2+、K+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有①Al3+;②Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO32﹣;⑦NO3﹣中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( ) 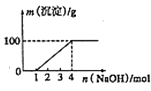
A.③⑤⑦
B.②③⑤⑦
C.①②③⑥⑦
D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SO2 |
B | CO2 | NaOH | NaCl | Na2CO3 |
C | HCl | NaOH | CaF2 | CH3COOH |
D | HNO3 | KOH | CaCO3 | CaO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
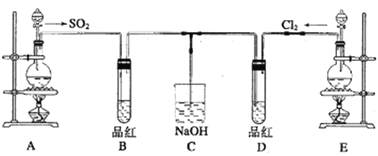
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com