
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
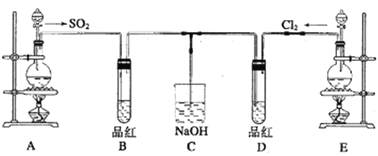
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
【答案】 取下分液漏斗的玻璃塞 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 褪色的品红溶液又恢复成红色 无明显现象 溶液变浑浊(或有沉淀生成) Cl2+SO2+2H2O=2HCl+H2SO4
MnCl2+Cl2↑+2H2O 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 褪色的品红溶液又恢复成红色 无明显现象 溶液变浑浊(或有沉淀生成) Cl2+SO2+2H2O=2HCl+H2SO4
【解析】试题分析:(1)打开A的分液漏斗活塞后,漏斗中液体未流下,说明分液漏斗内压强小于外界大气压;(2)装置E适合二氧化锰与浓盐酸加热制备Cl2;酸性KMnO4和浓盐酸反应生成Cl2、氯化锰、氯化钾、水;(3)SO2、Cl2都能使品红褪色,SO2漂白具有暂时性,加热后可以恢复原色,次氯酸是氧化性漂白,具有永久性。(4)若将B中品红换成Na2S溶液,通SO2后可以发生5 SO2 + 2 Na2S + 2 H2O == 3 S↓+ 4 NaHSO3;(5)SO2和Cl2 、H2O发生氧化还原反应生成HCl和H2SO4。
解析:(1)打开A的分液漏斗活塞后,漏斗中液体未流下,说明分液漏斗内压强小于外界大气压,可以取下分液漏斗的玻璃塞使分液漏斗液体顺利滴下;(2)装置E适合二氧化锰与浓盐酸加热制备Cl2,反应方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;酸性KMnO4和浓盐酸反应生成Cl2、氯化锰、氯化钾、水,反应离子方程式是2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(3)SO2、Cl2都能使品红褪色,SO2漂白具有暂时性,加热后可以恢复原色,次氯酸是氧化性漂白,具有永久性,所以给B、D两个试管分别加热,B试管褪色的品红溶液又恢复成红色、D试管无明显现象。(4)若将B中品红换成Na2S溶液,通SO2后发生5 SO2 + 2 Na2S + 2 H2O == 3 S↓+ 4 NaHSO3,现象是溶液变浑浊;(5)SO2和Cl2 、H2O发生氧化还原反应生成HCl和H2SO4,所以品红溶液不褪色,反应方程式是Cl2+SO2+2H2O=2HCl+H2SO4。
MnCl2+Cl2↑+2H2O;酸性KMnO4和浓盐酸反应生成Cl2、氯化锰、氯化钾、水,反应离子方程式是2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(3)SO2、Cl2都能使品红褪色,SO2漂白具有暂时性,加热后可以恢复原色,次氯酸是氧化性漂白,具有永久性,所以给B、D两个试管分别加热,B试管褪色的品红溶液又恢复成红色、D试管无明显现象。(4)若将B中品红换成Na2S溶液,通SO2后发生5 SO2 + 2 Na2S + 2 H2O == 3 S↓+ 4 NaHSO3,现象是溶液变浑浊;(5)SO2和Cl2 、H2O发生氧化还原反应生成HCl和H2SO4,所以品红溶液不褪色,反应方程式是Cl2+SO2+2H2O=2HCl+H2SO4。


科目:高中化学 来源: 题型:
【题目】下列实验操作或事实与预期实验目的或所得结论对应错误的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | CaO | 实验室用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中可能含有H2SO3 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过。已知充、放电的化学方程式为2Na2S2+NaBr3 ![]() Na2S4+3NaBr,下列说法正确的是( )
Na2S4+3NaBr,下列说法正确的是( )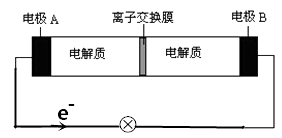
A.放电时,钠离子从右到左通过离子交换膜
B.放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
C.充电时,A极应与直流电源负极相连接
D.放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)第一电离能介于B、N之间的第二周期元素有种.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为。
(3)Fe3C晶体中碳元素为-3价,则其中基态铁离子的电子排布式为。
(4)甲醇(CH3OH)分子内的O-C-H键角(填“大于”、“等于”或“小于”)甲醛(H2C=O)分子内的O-C-H键角。
(5)BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是。
(6)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线吸收法可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 ![]() =(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
=(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 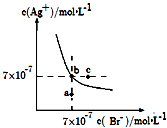
A.如图中a点对应的是AgBr的不饱和溶液
B.在t℃时,Ksp(AgBr)=4.9×10﹣13
C.在t℃时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)的平衡常数K≈816
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到以c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. NaHCO3= Na++ H++CO32- B. Ba(OH)2=Ba2++OH-
C. H2SO4=H2++SO42- D. Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确前是
A. Cl2通入水中:C12+H2O![]() 2H++C1—+ClO—
2H++C1—+ClO—
B. 将铜丝插入浓硝酸中:Cu+4H++2NO3—==Cu2++2NO2↑+2H2O
C. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3—==3Fe3++NO↑+4H2O
D. (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42—+2Ba2++2OH—=Fe(OH)2↓+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容积为1L的密闭容器中发生如下反应:C(s)+H2O(g)CO(g)+H2(g)
(1)维持温度不变,向该容器中充入2mol C(s)和2molH2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为
(2)在(1)中若起始时充入的是2.5molCO(g)和4mol H2(g),达到平衡后混合气体的平均相对分子质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com