
����ͭ�������õĵ����Ժ͵����ԣ��ڵ����͵��ӹ�ҵ��Ӧ�ù㷺��
��1����H2O2 ��H2SO4 �Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ��д��������Ӧ�����ӷ���ʽ ��
��2��ijѧϰС���á���ӵ��������ⶨ����CuSO4��5H2O�������������������I��������Ӧ�����������ʣ��Ĵ��ȣ��������£�ȡ0.625 g��������ˮ���ӹ���KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
��֪��I2��2S2O32��=S4O62����2I��
��ѡ�� ���ζ�ָʾ�����ζ��յ�������� ��
��CuSO4��Һ��KI��Ӧ�����ӷ���ʽΪ ��
��������CuSO4��5H2O����������Ϊ ��
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڽ����������ȷ����
A������ʵ����Ծݴ˰ѽ��塢��Һ�ֿ�
B���������Һ�ı��������ǽ����ܷ������������
C���������ķ�����������ʱ��ʹ�ð�Ĥֻ����С���Ӻ�����ͨ��
D��������磬���ڵ糡�����»������Ӿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ����ʦ��Ʒ�Ƽ��������棩 ���ͣ�?????
���ú�����ȡ���ʵ���У�������ȡ�ͷ�Һ����ʱҪ�õ���������
A����ƿ B����ͨ©�� C����Һ©�� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵ�ʹ�ò��漰��ѧ�仯����
A������������ˮ�� B����ʯ���������
C��������ʴ���� D��Һ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡĵ�����и���9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ��������������ȷ����
A��10 L 0.l mol?L-1��Na2CO3��Һ����������һ������3NA
B����״���£�22.4 L HF�ķ�����ΪNA
C��1 mol Fe��22.4 L��Cl2����״���£���ȼ�գ�ת�Ƶĵ�������Ϊ3NA
D��һ��������ij�ܱ�����ʢ��0.1 mol N2��0.3 mol H2����ַ�Ӧ��ת�Ƶ�����Ϊ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A���õ��������������Һ�еĵ⻯�أ�5I-+IO-3+3H2O=3I2+6OH-
B����H218O��Ͷ��Na2O2���壺 2H218O + 2Na2O2=4Na++ 4OH��+18O2��
C����100 mL 2 mol/L FeBr2��Һ��ͨ��4��48 L����������£�����ַ�Ӧ��2Fe2++ 2Br��+ 2Cl2 = 2Fe3+ + Br2+4Cl��
D��������Ͷ��ˮ�У�Na��H2O = Na����OH����H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ��һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������
A�����Ӱ뾶��Al3����Mg2����Na����F��
B���ȶ��ԣ�HF��HCl��HBr��HI
C�����ԣ�H4SiO4��H3PO4��H2SO4��HClO4
D�����ԣ�Al(OH)3��Mg(OH)2��Ca(OH)2��KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶�9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��100g̼����ȫȼ�����������У�COռ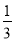 ��CO2ռ
��CO2ռ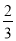 ����C(s)+
����C(s)+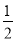 O2(g) =CO(g)����H=-110.35kJ/mol��CO(g)+
O2(g) =CO(g)����H=-110.35kJ/mol��CO(g)+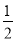 O2(g)=CO2(g)����H=-282.57 kJ/mol������Щ̼��ȫȼ����ȣ���ʧ��������
O2(g)=CO2(g)����H=-282.57 kJ/mol������Щ̼��ȫȼ����ȣ���ʧ��������
A��392.92kJ B��2489.44kJ
C��784.92kJ D��3274.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������տ������һ�и���10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
(13��)��ҵ�ϳ�����ұ��п�����е�п������ZnO��FeO��Fe2O3��CuO��Al2O3�����ʣ�����������ZnSO4��6H2O���壬�乤���������£��й������������ʱ��pH���±���

�������� | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Zn��OH��2 |
��ʼ������pH | 3.3 | 1.5 | 6.5 | 5.4 |
������ȫ��pH | 5.2 | 3.7 | 9.7 | 8.0 |
��1���������������жദ�漰�����ˡ���ʵ�����й��˲�����Ҫʹ�õIJ���������________��
��2���ڡ����Ӣ����У����ټ�������H2O2��Һ��Ŀ����_____��ΪʹFe��OH��3��Al��OH��3������ȫ����Zn��OH��2��������Ӧ������Һ��pH��ΧΪ______��Ϊ��������pH��Χ��ѡ�������Լ���ҩƷ��________��
A��ZnO B����ˮ C������NaOH D��ZnCO3
��3���ڡ����Ӣ����У�����Zn�۵�������_______��������A����������_______��
��4�������£���֪Ksp��Cu��OH��2��=2��10-20��ijCuSO4��Һ��c��Cu2+��=0.02mol/L�����Ҫ����Cu��OH��2��������Ӧ������ҺpH����___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com