
(8��)����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
(1)��֪��N2(g)+O2(g)="2NO(g) " ��H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g) ��H=��92.4kJ/mol
2NH3(g) ��H=��92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ/mol
��ɰ���������������һ�����������ˮ�������Ȼ�ѧ����ʽ��
4NH3��g��+5O2��g��==4NO��g��+6H2O��g������H= kJ��mol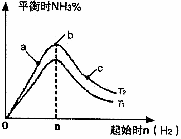
(2)ij����С���о����������������������£��ı���ʼ�����������ʵ����Է�ӦN2(g)+3H2(g)
 2NH3(g)��Ӱ�죮ʵ������ͼ��ʾ��(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)
2NH3(g)��Ӱ�죮ʵ������ͼ��ʾ��(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)
��ͼ����T1��T2�Ĺ�ϵ�ǣ�T1_______T2(����ڡ������ڡ������ڡ�����ȷ����)
�ڱȽ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������͵���________(����ĸ)��
(3)��һ���¶Ⱥʹ����£���3.2mol H2��1.2molN2�����һ���ݻ�Ϊ2L���ܱ������з�����Ӧ����2minĩʱ��Ӧǡ�ô�ƽ�⣬��ʱ������0.8mol NH3������������µ�ƽ�ⳣ����(д��������̣��������С�����һλ)
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��Դ�Ŀ����������������Ŀɳ����Է�չϢϢ��أ�
��Դ�Ŀ����������������Ŀɳ����Է�չϢϢ��أ�| 1 |
| 2 |
| ���¡���ѹ |
| ���� |
| P |
| P0 |
| O | 2- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ӱ�ʡ����������¿���ѧ�Ծ��������棩 ���ͣ������
��1����Դ�Ŀ����������������Ŀɳ����Է�չϢϢ��ء�
��֪���� Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ��H1=a kJ/mol
��CO(g)+1/2 O2(g)=CO2(g) ��H2=b kJ/mol
��4Fe(s)+3O2(g)=2Fe2O3(s) ��H3=c kJ/mol
��C��ȼ����____________________________kJ.mol-1
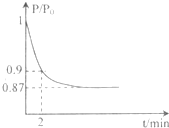
��2��ijʵ��С��ģ�ҵ�ϳɰ���ӦN2+3H2 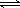 2NH3
��H =-92.4 kJ/mol,��ʼ���ǽ�N2��H2�������20mol
(�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
2NH3
��H =-92.4 kJ/mol,��ʼ���ǽ�N2��H2�������20mol
(�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
�ٷ�Ӧ��ƽ��ı�־�ǣ�����ĸ���ţ�_____________
A��ѹǿ���ֲ���
B�������ܶȱ��ֲ���
C��NH3������������N2���������ʵ�2��
��2minʱ����C(N2)�仯��ʾ��ƽ����Ӧ����Ϊ___________
�������N2��ת���ʿɲ�ȡ�Ĵ�ʩ��_______________
A������ϵ�а������1��1�ٳ���N2��H2
B�������NH3
C�������¶�
D������He��ʹѹǿ����
E������һ������N2
��3��25��Cʱ,BaCO3��BaSO4���ܶȻ������ֱ���8��10��9��1��10��10��ij����BaCO3����������Һ��c(CO32-)=0.2mol/L���������������Na2SO4��Һ����Ҫ���� BaSO4����������Na2SO4��Һ�����ʵ���Ũ����С��________mol /L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ӱ�ʡ��ɽ�и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��Դ�Ŀ����������������Ŀɳ����Է�չϢϢ��ء�
I����֪��Fe2O3(s)��3C(s)= 2Fe(s)��3CO(g) ��H1=a kJ��mol-1
CO(g)��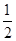 O2(g)=CO2(g)
��H2=b kJ��mol-1
O2(g)=CO2(g)
��H2=b kJ��mol-1
4Fe(s)��3O2(g)=2Fe2O3(s) ��H3=c kJ��mol-1
��C��ȼ����________kJ��mol-1
II����1������ԭ��صĹ���ԭ�������л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���____(�����)��
A��C(s)+CO2(g)=2CO(g) B��NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C��2H2O(l) = 2H2(g)+O2(g) D��2CO(g)+O2(g)=2CO2(g)
�������ڵ�K2CO3��CO2Ϊ��Ӧ�Ļ�����������ѡ��Ӧ��Ƴ�һ��ԭ��أ���д����ԭ��صĸ�����Ӧ��___________��
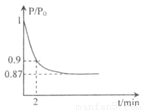
��2��ijʵ��С��ģ�ҵ�ϳɰ���ӦN2(g)��3H2(g)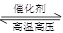 2NH3(g) ��H=-92.4kJ��mol-1����ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ����С���ӦǰѹǿΪP0����Ӧ������ѹǿ��P��ʾ����Ӧ������
2NH3(g) ��H=-92.4kJ��mol-1����ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ����С���ӦǰѹǿΪP0����Ӧ������ѹǿ��P��ʾ����Ӧ������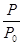 ��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
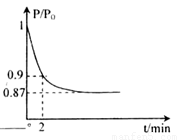
��ش��������⣺
�ٷ�Ӧ��ƽ��ı�־�ǣ�����ĸ���ţ�________��
A��ѹǿ���ֲ���
B�������ܶȱ��ֲ���
C��NH3������������N2���������ʵ�2��
��2minʱ����c(N2)�仯��ʾ��ƽ����Ӧ����Ϊ________��
�������N2��ת���ʿɲ�ȡ�Ĵ�ʩ��________��
A������ϵ�а������1��1�ٳ���N2��H2
B�������NH3
C�������¶�
D������He��ʹѹǿ����
E������һ������N2
��3��25��Cʱ��BaCO3��BaSO4���ܶȻ������ֱ���8��10��9��1��10��10��ij����BaCO3����������Һ�У�c(CO32-)=0.2mol��L-1���������������Na2SO4��Һ����Ҫ���� BaSO4����������Na2SO4��Һ�����ʵ���Ũ����С��________mol • L��1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com