
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
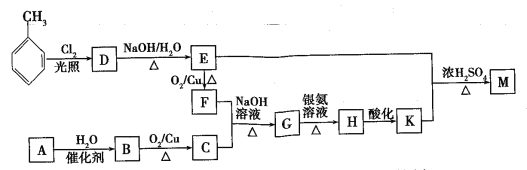
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+ 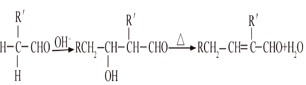 。请回答下列问题:
。请回答下列问题:
(1)K的名称是___________;G中含有的官能团名称是______________。
(2)写出D→E的化学方程式____________________________________。
(3)A→B的反应类型是_______;
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。①遇FeCl3溶液发生显色反应;②能发生银镜反应;③除苯环以外不再含有其他环状结构。其中核磁共振氢谱为五组峰的结构简式为____。
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)____________。
【答案】苯丙烯酸 碳碳双键、醛基  加成反应 16
加成反应 16 ![]() C H3H2OH
C H3H2OH![]() CH3CHO
CH3CHO ![]() CH3CH=CH CHO
CH3CH=CH CHO ![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH ![]() CH3CH2CH=CH2
CH3CH2CH=CH2
【解析】
气态烃A在标准状况下的密度是1.25g/L,则M=1.25g/L×22.4L/mol=28g/mol,能作为果实催熟剂,则A为乙烯,结构简式为CH2=CH2,CH2=CH2与水在催化剂作用下发生加成反应生成B为乙醇,乙醇在铜的催化下与氧气发生氧化反应生成C为乙醛;甲苯在光照条件下与氯气发生取代反应生成D为![]() ,
,![]() 在氢氧化钠溶液中加热发生取代反应生成E为
在氢氧化钠溶液中加热发生取代反应生成E为![]() ,
,![]() 在铜的催化下与氧气发生氧化反应生成F为苯甲醛,苯甲醛和乙醛在氢氧化钠溶液中加热发生类似RCH2CHO+
在铜的催化下与氧气发生氧化反应生成F为苯甲醛,苯甲醛和乙醛在氢氧化钠溶液中加热发生类似RCH2CHO+ +H2O的反应,生成G为
+H2O的反应,生成G为![]() ,
,![]() 发生银镜反应生成H为
发生银镜反应生成H为![]() ,
,![]() 酸化生成为
酸化生成为![]() ,
,![]() 与
与![]() 在浓硫酸催化下发生酯化反应生成M为
在浓硫酸催化下发生酯化反应生成M为![]() ,据此答题。
,据此答题。
(1)由分析可知:K为![]() ,名称是苯丙烯酸;G为
,名称是苯丙烯酸;G为![]() ,含有的官能团名称是碳碳双键、醛基;故答案为:苯丙烯酸,碳碳双键、醛基。
,含有的官能团名称是碳碳双键、醛基;故答案为:苯丙烯酸,碳碳双键、醛基。
(2)D→E的化学方程式为![]() +NaOH
+NaOH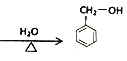 +NaCl,故答案为:
+NaCl,故答案为:![]() +NaOH
+NaOH +NaCl。
+NaCl。
(3)A→B是CH2=CH2与水在催化剂作用下发生加成反应生成乙醇,反应类型是加成反应,故答案为:加成反应。
(4)K为![]() ,同时满足条件的同分异构体:①遇FeCl3溶液发生显色反应则含有酚羟基;②能发生银镜反应则含有醛基;③除苯环以外不再含有其他环状结构,若苯环上只有两个取代基,则为酚羟基和-CH=CHCHO或酚羟基和-C(CHO)=CH2,位置上有邻、间、对位,故有6种同分异构体; 若苯环上有三个取代基则为酚羟基、-CH=CH2、-CHO,先定酚羟基、-CH=CH2在苯环上有邻、间、对位,然后再取代醛基分别有4种、4种和2种共10种,故总共符合条件的同分异构体有16种;其中核磁共振氢谱为五组峰的结构简式为
,同时满足条件的同分异构体:①遇FeCl3溶液发生显色反应则含有酚羟基;②能发生银镜反应则含有醛基;③除苯环以外不再含有其他环状结构,若苯环上只有两个取代基,则为酚羟基和-CH=CHCHO或酚羟基和-C(CHO)=CH2,位置上有邻、间、对位,故有6种同分异构体; 若苯环上有三个取代基则为酚羟基、-CH=CH2、-CHO,先定酚羟基、-CH=CH2在苯环上有邻、间、对位,然后再取代醛基分别有4种、4种和2种共10种,故总共符合条件的同分异构体有16种;其中核磁共振氢谱为五组峰的结构简式为![]() ,故答案为:16,
,故答案为:16,![]() 。
。
(5)乙醇在铜作催化剂条件下与氧气反应生成乙醛,乙醛在氢氧化钠溶液中加热反应生成CH3CH=CHCHO,CH3CH=CHCHO与氢气发生加成反应生成CH3CH2CH2CH2OH,CH3CH2CH2CH2OH在浓硫酸作用下加热发生消去反应生成CH3CH2CH=CH2,合成路线如下:CH3H2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2,故答案为:CH3H2OH
CH3CH2CH=CH2,故答案为:CH3H2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2。
CH3CH2CH=CH2。


科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
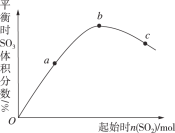
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.对于可逆反应CO+H2O(g)![]() CO2+H2,回答下列问题:
CO2+H2,回答下列问题:
(1)830 K时,若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为 _____________;平衡常数K的值为 _____________。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为_____________ 。
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol·L-1c(CO)=0.6 mol·L-1c(H2O)=3 mol·L-1,c(H2)=2 mol·L-1请判定该体系中反应进行的方向:______________ (填“正向进行”“逆向进行”或“达到平衡”)。
Ⅱ恒温恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为 _______ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为 _______mol。
(3)若开始时放入x mol A2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x= ______,y= _________。
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2 L恒容密闭容器中充入1mol A,发生A(g) ![]() B(g) + C(g)反应。反应过程中c(C)随时间变化的曲线如下图所示,下列说法不正确的是( )
B(g) + C(g)反应。反应过程中c(C)随时间变化的曲线如下图所示,下列说法不正确的是( )
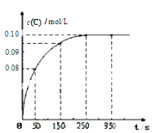
A.反应在 0 ~50 s 的平均速率v(C)=1.6×10-3mo1/(L s)
B.该温度下,反应的平衡常数值为0.025
C.反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆)
D.保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究温度对化学反应![]() 的影响,在其他条件相同时,将
的影响,在其他条件相同时,将![]() 和
和![]() 充入体积为2L的恒容密闭容器中,测得
充入体积为2L的恒容密闭容器中,测得![]() 的物质的量分数随时间
的物质的量分数随时间![]() 变化的实验数据如下:
变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
| |
下列说法正确的是 ![]()
![]()
A. ![]() 温度下,
温度下,![]() 之间,
之间,![]() 的平均反应速率为
的平均反应速率为![]()
B. 在![]() 温度下,该反应有可能在70min时已达到平衡状态
温度下,该反应有可能在70min时已达到平衡状态
C. 由表中数据推测,![]()
D. 由表中数据可知,温度越高,![]() 与
与![]() 的反应限度越大
的反应限度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各反应,判断有关物质还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO+2H2O+Fe(NO3)3
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,通入![]() 前装置Ⅰ中溶液呈红色。下列说法不合理的是
前装置Ⅰ中溶液呈红色。下列说法不合理的是
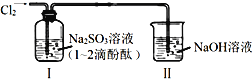
A.通入![]() 后,装置Ⅰ中发生了氧化还原反应
后,装置Ⅰ中发生了氧化还原反应
B.![]() 与
与![]() 溶液反应的离子方程式是:
溶液反应的离子方程式是:![]()
C.通入![]() 后,装置Ⅰ中溶液不褪色
后,装置Ⅰ中溶液不褪色
D.装置Ⅱ的作用是吸收尾气,防止污染空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com