
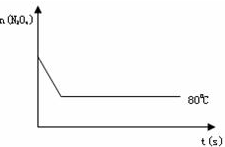
 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
 2NO2
2NO2
| ||
| 20s |
| 0.8mol-0.2mol |
| 0.8mol |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:









查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?崇明县二模)取等物质量浓度的NaOH 溶液两份甲和乙各100mL,分别向甲、乙中通入不等量的CO2,然后向两溶液中逐滴加入2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸溶液的体积之间关系如图所示,试回答下列问题:
(2011?崇明县二模)取等物质量浓度的NaOH 溶液两份甲和乙各100mL,分别向甲、乙中通入不等量的CO2,然后向两溶液中逐滴加入2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸溶液的体积之间关系如图所示,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com