
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是_________________________。
(2)第④步中,相关的离子方程式是_______________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是__________________。
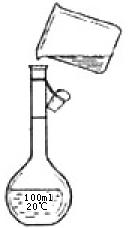
(4)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图。图中的错误是____________________________________________。
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
三种物质的溶解度(20℃)如表所示,下列说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
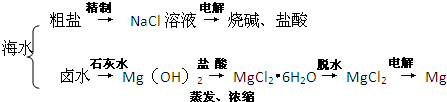
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市金山区高三一模化学试卷(解析版) 题型:填空题
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因 。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com