
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是__________;被还原元素的元素符号是_________;
(2)试比较KClO3和CO2的氧化性强弱____________________________________;
(3)消毒时,ClO2还可以将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物,此过程说明ClO2具有___________ (填“氧化”或“还原”)性;
(4)当转移0.2mol电子时,生成的ClO2在标准状况下的体积为_________________________ ;
(5)有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,将这6种物质分别填入下面对应的横线上,并将该化学方程式配平。
________+________Na2SO3+________→________ +________ +________+_____H2O
【答案】H2C2O4 Cl KClO3﹥CO2 氧化 4.48L 2KIO3 5 H2SO4 5Na2SO4 K2SO4 I2 1
【解析】
(1)对于氧化还原反应的分析,主要从以下两条线进行:
化合价降低→得电子→氧化剂→氧化性→被还原→还原产物→还原反应;
化合价升高→失电子→还原剂→还原性→被氧化→氧化产物→氧化反应。
(2)依据以下原理进行分析。氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。
(3)写出反应方程式,从反应物中ClO2 中Cl的价态变化,确定其表现的性质。
(4)从方程式中建立ClO2 与转移电子数的关系式,然后进行求解。
(5)从氧化性由强制弱,还原性由强制弱,确定反应物与生成物。
(1)对于反应2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,
KClO3中的Cl由+5价降低到+4价,H2C2O4中的C由+3价升高到+4价。该反应中还原剂是含有价态升高元素的反应物,其化学式是H2C2O4;被还原元素是反应物中含有价态降低的元素,其元素符号是Cl ;答案:H2C2O4;Cl;
(2)在此反应中,KClO3是氧化剂,CO2是氧化产物,氧化性是氧化剂大于氧化产物,所以氧化性:KClO3 ﹥ CO2;答案:KClO3 ﹥ CO2;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,则ClO2 中Cl价态降低,此过程说明 ClO2 具有 氧化性;答案:氧化;
(4)根据价态变化,可建立以下关系式:KClO3——ClO2——e-,
当转移 0.2mol 电子时,生成的ClO2为0.2mol,在标准状况下的体积为![]() ;答案:4.48L;
;答案:4.48L;
(5)有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,
从价态变化看,含价态变化元素的物质为Na2SO3中的S(升高)和KIO3中的I(降低)、I2(升高),但反应物中变价元素的价态应有升有降,所以KIO3中的I(降低)为反应物,I2(升高)为生成物,于是得出反应的关系式:KIO3+Na2SO3——Na2SO4+ I2,依据电子守恒配平,得关系式:2KIO3+5Na2SO3——5Na2SO4+ I2,再据质量守恒配平,得到下列方程式:2KIO3+ 5Na2SO3+H2SO4=5Na2SO4 +K2SO4+ I2+ H2O。答案:2KIO3;5;H2SO4;5Na2SO4;K2SO4;I2;1。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
①属于盐的是________(填序号),写出这种物质在水溶液中的电离方程式__________。
②上述物质中有一种与其他三种物质均能反应,此物质是__________(填序号)。
(2)酸性条件下,次磷酸(H3PO2)可发生下列反应而用于化学镀银。
口Ag++口H3PO2+口 =口Ag+口H3PO4+口
试回答下列问题
①该反应的氧化产物是_________。
②请将反应物和生成物补充完整并配平,并用双线桥法标出电子转移的数目。______
③若反应中生成10.8gAg,则转移电子的数目约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
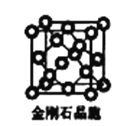
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某双原子分子构成的气体,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA。对质量为m g的该气体,求:(用含M、NA、m符号的式子表示)。
(1)在标准状况下,该气体的体积为________L,密度为________g·L-1。
(2)该气体所含的原子总数为________个。
(3)该气体的一个分子的质量约为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况时,8.96L的容器里所含CO的质量为11.2g,则一氧化碳的摩尔质量为____________ g/mol ;
(2)3.01×1023个OH-的物质的量是 __________ mol,质量为_____g,其质子数为________(用NA表示),电子数为 ___________(用NA表示);
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
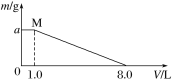
【题目】将FeCl3、CuCl2混合溶液加入一定质量的铁粉中充分反应,所加混合溶液的体积与反应后剩余固体质量如图所示。已知原混合溶液中Cu2+浓度为0.140 mol·L-1,经检测M点时溶液中无Cu2+。
求:(1)c(FeCl3)=______mol·L-1。
(2)铁粉的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示, 下列说法中不正确的是( )

A. 1mol该有机物和过量的金属钠反应最多可以生成1.5 molH2
B. 该有机物消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C. 可以用酸性KMnO4溶液检验其中的碳碳双键
D. 该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
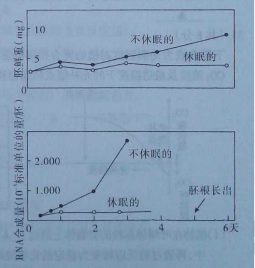
(1)通过不休眠种子与休眠种子胚的鲜重比较,得出其中结合水/自由水比值高的是_______种子;不休眠的种子萌发6天后至形成叶片前,干重会____________,原因是:____________。
(2)不休眠的种子萌发后胚中的RNA合成量____________,经分析种子的淀粉含量下降而葡萄糖含量升高,推测某些RNA控制翻译合成了______________。
(3)第5天萌发种子的胚根长出,此时整个种子内DNA的含量与不萌发种子比__________(相等、增多、减少),推测的理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:回答下列问题:

⑴A的化学名称是______;与A互为同分异构体的芳香化合物还有 _____种,其中核磁共振氢谱图上显示有5个峰,且峰面积之比为1:2:2:2:3的物质的结构简式为:________________。
⑵A→B的反应类型是_______。
⑶A→E的化学方程式为____________________。
⑷A与酸性KMnO4溶液反应可得到D,写出D的结构简式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com