
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
(1)第一周期ⅠA族 2Cl-+2H2O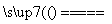 2OH-+H2↑+Cl2↑[或2NaCl(熔融)
2OH-+H2↑+Cl2↑[或2NaCl(熔融)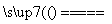 2Na+Cl2↑]
2Na+Cl2↑]
(2)纯碱(或苏打) Cl2+2Na2CO3+H2O===NaClO+NaCl+2NaHCO3 紫
(3)NaH Na2O2和Na2C2 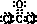 金属晶体
金属晶体
(4)氢 正四面体
[解析] 根据题给信息,可推出A、B、D、E、F分别是H、C、O、Na、Cl。(1)工业上通常电解饱和食盐水制氯气,电解的离子方程式为2Cl-+2H2O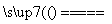 2OH-+H2↑+Cl2↑。(2)C、O、Na组成的盐中,Na的质量分数为43%的是Na2CO3,其俗名是纯碱(或苏打);首先写出化学方程式Cl2+H2O===HClO+HCl、HClO+Na2CO3===NaClO+NaHCO3、HCl+Na2CO3===NaCl+NaHCO3,然后将以上三个方程式合并得Cl2+2Na2CO3===NaClO+NaCl+2NaHCO3;产物中的NaClO具有强氧化性,能将I-氧化成I2,I2易溶于有机溶剂CCl4,I2的CCl4溶液呈紫色。(3)五种元素组成的物质中能形成阳离子的仅有Na,结合题给信息,可推知a是NaH、b是Na2O2、Na2C2;c为COCl2,其电子式为
2OH-+H2↑+Cl2↑。(2)C、O、Na组成的盐中,Na的质量分数为43%的是Na2CO3,其俗名是纯碱(或苏打);首先写出化学方程式Cl2+H2O===HClO+HCl、HClO+Na2CO3===NaClO+NaHCO3、HCl+Na2CO3===NaCl+NaHCO3,然后将以上三个方程式合并得Cl2+2Na2CO3===NaClO+NaCl+2NaHCO3;产物中的NaClO具有强氧化性,能将I-氧化成I2,I2易溶于有机溶剂CCl4,I2的CCl4溶液呈紫色。(3)五种元素组成的物质中能形成阳离子的仅有Na,结合题给信息,可推知a是NaH、b是Na2O2、Na2C2;c为COCl2,其电子式为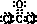 ;五种元素中只有Na形成的单质只存在一种类型的作用力且可导电,金属钠属于金属晶体。(4)H2O和CH4形成的可燃冰(CH4·nH2O)是一类新能源物质,其中H2O分子间形成氢键,CH4的空间构型为正四面体。
;五种元素中只有Na形成的单质只存在一种类型的作用力且可导电,金属钠属于金属晶体。(4)H2O和CH4形成的可燃冰(CH4·nH2O)是一类新能源物质,其中H2O分子间形成氢键,CH4的空间构型为正四面体。


科目:高中化学 来源: 题型:
若使0.5mol甲烷完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需氯气的物质的量为( )
A.2.5mol B.2mol
C.1.25mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液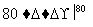 NaClO3溶液
NaClO3溶液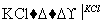 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
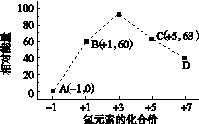
(4)一定条件下,在水溶液中1 mol Cl-、ClO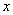 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
| M | N | ||
| X | Y |
(1)元素X在周期表中的位置是第________周期、第________族,其单质可采用电解熔融________的方法制备。
(2)M、N、Y三种元素最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是________。(填化学式)
(3)气体分子(MN)2的电子式为________。(MN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.同一周期元素的原子,半径越小越容易失去电子
B.周期表中的所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构
D.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
丙烯酸(CH2 = CH—COOH)的性质可能有:
① 加成反应 ② 水解反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应
A.只有①③ B.只有①③④ C.只有①③④⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近。 X有如下的转化关系:其中,C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色胶状沉淀,E溶液的焰色反应火焰呈黄色,M是一种常见金属,过量的M与L可生成Q和I。
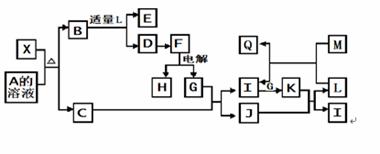
(1)X与A溶液反应的离子方程式为
(2)把红热的木炭投入到L的浓溶液中,可发生剧烈反应,①化学方程式为_________________
②若把产生的气体通入足量的饱和碳酸氢钠溶液中,再把逸出的气体干燥后通入足量的过氧化钠固体,充分反应后,再通入水中,最后收集到的气体是 ______________________
③若把产生的气体直接通入足量的澄清石灰水中,现象是__________________________
(3)将K、I、G混合气体充满容器后倒置于水槽中,气体完全溶解,溶液充满整个容器。则三者的物质的量之比可能为_______
A.1∶1 ∶1 B.4∶2∶2.5 C.4∶8∶7 D.6∶4∶5
所得溶液的浓度范围 (标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com