
【题目】下列行为符合实验安全要求的是( )
A.酒精灯着火时用湿抹布熄灭
B.冷凝管中的水流方向是从上口进入,下口排出
C.将鼻孔凑到集气瓶口闻气体的气味
D.发现家中天然气泄漏,立即打开抽油烟机
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2) 被誉为“固体润滑剂之王”,利用低品质的辉钼矿( 含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:
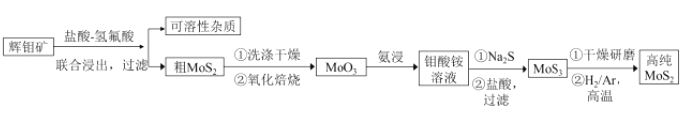
回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为________.
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为________如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式____________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是___________。
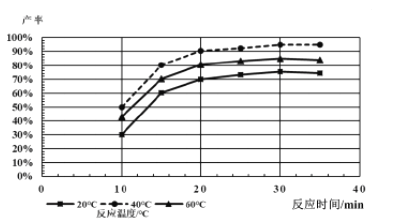
利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:__________。
(5)高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为________________。
(6)已知Ksp(BaSO4) =1.1×10-10,Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)___________(结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4 , 下列说法正确的是( )
A.O4和O2互为同位素
B.O4转化O2为物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4气体和O2含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
选 项 | A | B | C | D |
物 质 | Na2O2 | H2O | HCl | NaCl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝锰合金可作炼钢脱氧剂。某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:取20.00mL 0.015mol/L K2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2mL.
Ⅱ过硫酸铵[(NH4)2S2O8]催化氧化滴定法测定锰含量
取mg铝锰合金于锥形瓶中,加入适量的浓磷酸,加热至完全溶解,稀释冷却谣匀,再加入少量的硝酸银溶液、过量的过硫酸铵溶液,加热煮沸至无大量气泡冒出,冷却至室温(此时溶液中锰的化合价为+7),用标定的硫酸亚铁铵溶液进行滴定,根据实验数据计算铝锰合金中锰的含量。
[查阅资料]①酸性条件下,Cr2O72-具有很强的氧化性,易被还原为绿色的Cr3+;
②R溶液的变色原理: ![]()
(1)Ⅰ中步骤1.2需要的玻璃仪器有锥形瓶、胶头滴管,_______、________。
(2)Ⅰ中滴定过程,主要反应的离子方程式是________。
(3)Ⅰ中步骤2的主要作用是_________
(4)Ⅱ中硫酸亚铁铵溶液的滴定浓度是_________mol/L (用含V1、V2的代数式表示)。
(5)Ⅱ中加入硝酸银溶液的目的是________。
(6)Ⅱ中若未加热煮沸无大量气泡冒出,锰含量测定结果将_______(填“偏大”“偏小”或“无影响”)。
(7)为了提高该实验的准确度和可靠度,需进行________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
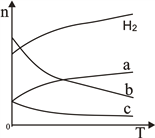
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 欲实现铁上镀锌,用锌作阴极
B. 电解精炼铜,若转移2mol电子,阴极质量增加64g
C. 硫酸工业中采用沸腾炉以增大固气接触面积,加快反应速率
D. 镁的提取工业中,MgCl2·H2O在HCl气流中脱水以防止MgCl2水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用某浓度的NaOH溶液滴定20.00mL等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
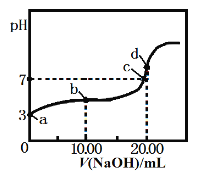
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com