
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g)
△H=+206.0kJ•molˉ1
CO(g)+3H2(g)
△H=+206.0kJ•molˉ1
II:CO(g)+2H2(g) CH3OH(g)
△H=-129.0kJ•molˉ1
CH3OH(g)
△H=-129.0kJ•molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
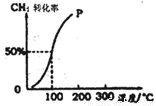
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.平衡常数K增大 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡c(H2)/c(CH3OH)减小
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将CO2+氧化成CO3+,然后以CO3+做氧化剂再把水中的甲醇氧化成CO2而净化。若下图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OHˉ向 极移动。净化含1mol甲醇的水,燃料电池转移电子 mol。

(16分)(1)CH4(g)+ H2O(g) CH3OH(g)+H2(g)
△H=+77.0kJ•molˉ1(3分,焓变写错扣1分,用等号不扣分)
CH3OH(g)+H2(g)
△H=+77.0kJ•molˉ1(3分,焓变写错扣1分,用等号不扣分)
(2)0.003mol•Lˉ1•minˉ1(2分,单位写错0分) 6.75×10ˉ4(2分)
(3)C、D(共2分,只答对一个给1分,答错一个0分)
(4)O2+2H2O+4eˉ=4OHˉ或3O2+6H2O+12eˉ=12OHˉ(3分,电极反应式没配平0分) 负(2分) 6(2分)
【解析】
试题分析:(1)根据盖斯定律可知,已知反应I+II可得:CH4(g)+ H2O(g)= CH3OH(g)+H2(g) △H=+77.0kJ•molˉ1;(2)CH4的起始浓度为1.0mol÷100L=0.01mol•Lˉ1,读图可知100℃时其平衡转化率为50%,则CH4的变化浓度为0.01mol•Lˉ1×50%=0.005mol•Lˉ1,则v(CH4)= 0.005mol•Lˉ1÷5min=0.001mol•Lˉ1•minˉ1,根据系数之比等于速率之比可知,v(H2)=3×v(CH4)= 0.003mol•Lˉ1•minˉ1;根据变化浓度之比等于系数之比,则反应I:
CH4(g) + H2O(g)  CO(g)
+ 3H2(g)
CO(g)
+ 3H2(g)
起始浓度/ mol•Lˉ1 0.01 0.01 0 0
变化浓度/ mol•Lˉ1 0.005 0.005 0.005 0.015
平衡浓度/ mol•Lˉ1 0.005 0.005 0.005 0.015
K=[c(CO)•c3(H2)]/[c(CH4)•c(H2O)]= [0.005×0.0153]/[ 0.005×0.005]=6.75×10ˉ4
(3)反应II是气态物质体积减小的反应,缩小容器体积,能增大各组分浓度,也能增大压强,平衡向正反应方向移动,但是平衡常数保持不变,因为温度不变平衡常数K不变,故A错误;同时增大反应物和生成物的浓度,正、逆反应速率均增大,但是v(正)>v(逆),所以平衡右移,故B错误;增大压强平衡右移,使生成物的量增加,故C正确;增大压强平衡向正反应方向移动,反应物浓度减小,生成物浓度增大,则重新平衡后反应物浓度/生成物浓度的值减小,故D正确;(4)甲醇完全燃烧生成CO2和H2O,CO2和过量KOH反应生成K2CO3和H2O,则该电池负极的主要反应物和产物分别是CH3OH、CO32ˉ,碳元素由-2价升为+4价,则CH3OH-6eˉ→CO32ˉ,由于KOH是强碱,应该用OHˉ使左右电荷守恒,则CH3OH-6eˉ+8OHˉ→CO32ˉ,根据氢、氧原子个数守恒可得,负极反应式为CH3OH-6eˉ+8OHˉ=CO32ˉ+6H2O或2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O;而正极的主要反应物是O2,同理可推断正极反应式为O2+2H2O+4eˉ=4OHˉ或3O2+6H2O+12eˉ=12OHˉ;放电时负极流出电子,正极流入电子,则阴离子移向负极,阳离子移向正极,则溶液中的OHˉ移向负极;根据系数之比等于物质的量之比,则1mol甲醇完全反应失去6mol电子,因此该燃料电池转移6mol电子。
考点:考查化学反应原理,涉及热化学方程式的书写、盖斯定律的应用、平均反应速率的计算、平衡转化率和化学平衡常数的计算、化学平衡、燃料电池的工作原理等知识。


科目:高中化学 来源: 题型:
 (1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
(1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届浙江省杭州市高三上学期期中七校联考化学试卷(带解析) 题型:填空题
(8分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
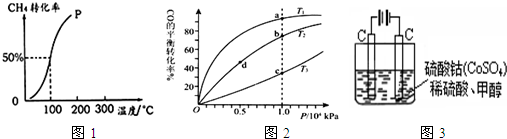
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极反应式
负极 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com