
【题目】对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
回答以下问题:
(1)实验①加热时放出的气体也可以使溴水溶液褪色,说明该气体具有____性。
(2)实验②加碱调至碱性后,加热时放出气体,发生反应的离子方程式为____。
(3)实验③不能确认SO42-在溶液中是否存在的原因是____(用化学方程式表示)。
(4)如何对实验③稍加改进即可确认SO42-在溶液中是否存在。其改进为:____。
【答案】(1)还原;(2)NH4++OH-![]() NH3↑+H2O;(3)Cl2+H2SO3+H2O=2HCl+H2SO4;(4)先加HCl酸化,无明显现象,再加BaCl2溶液,若有白色沉淀产生,则有SO42-,反之则无。
NH3↑+H2O;(3)Cl2+H2SO3+H2O=2HCl+H2SO4;(4)先加HCl酸化,无明显现象,再加BaCl2溶液,若有白色沉淀产生,则有SO42-,反之则无。
【解析】
试题分析:①加热时放出气体能使品红溶液褪色,此气体为SO2,说明含有H2SO3;②溶液碱性条件下,加热放出气体,此气体使湿润的红色石蕊试纸变蓝,说明此气体为NH3,原溶液中含NH4+;③加入氯水,溶液略显黄色,说明含Br-,但加入BaCl2溶液后,产生BaSO4,不能说明原溶液中含有SO42-,因为可能是H2SO3被氧化得到,(1)溴水具有氧化性,能使溴水褪色,说明SO2具有还原性;(2)NH4++OH-![]() NH3↑+H2O;(3)Cl2具有强氧化性,Cl2+H2SO3+H2O=2HCl+H2SO4;(4)先加盐酸酸化,除去H2SO3,无现象,再加BaCl2溶液,观察是否有沉淀产生,若有沉淀产生,则有SO42-,反之则无。
NH3↑+H2O;(3)Cl2具有强氧化性,Cl2+H2SO3+H2O=2HCl+H2SO4;(4)先加盐酸酸化,除去H2SO3,无现象,再加BaCl2溶液,观察是否有沉淀产生,若有沉淀产生,则有SO42-,反之则无。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:
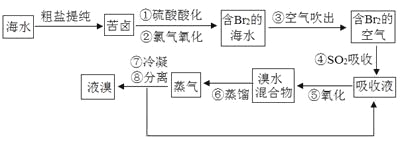
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_____________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是____________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为__________,制得的气体可用如图所示装置收集,则气体应从______(填“A”或“B”)通入。
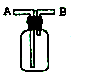
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH 溶液至过量,现象依次为_______、_________、__________。
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成____物质______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,A的M电子层有1个电子,B的最外层电子数为内层电子数的2倍,C的最高化合价为最低化合价绝对值的3倍,C与D同周期,D的原子半径小于C。
(1)B位于元素周期表第____周期第____族。
(2)C2-离子的结构示意图为____。A+、C2-、D-中离子半径最小的是____。(用具体离子符号表示)
(3)BC2与二氧化碳的结构相似,其结构式为____。A2C的电子式为____。
(4)A、D元素最高价氧化物对应水化物相互反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现利用下图所示装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。

(1)装置B中发生反应的化学方程式是:_______________________
(2)装置D中碱石灰的作用是________________
(3)停止反应,待B管冷却后,取其中的固体,加人过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________________________。
(4)为利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①物质A可以是__________,作用是 ______________。
A.酸性高锰酸钾溶液
B.盐酸
C.硝酸
D.双氧水
E.氯气
② 中从FeCl3稀溶液到FeCl3·6H2O晶体的主要操作包括蒸发浓缩、降温结晶、过滤,该流程中需保持盐酸过量,主要原因是:(结合离子方程式简要说明)_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②乙烷 ③乙苯 ④乙炔 ⑤二氧化硫 ⑥甲苯 ⑦苯 ⑧异戊二烯
A. ②③⑥ B. ②③⑤⑥⑦⑧ C. ②⑦ D. ②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用直接加热氧化铝的方法冶炼得到铝
B.海水中含有钾元素,只需经过物理变化可以得到钾单质
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.高炉炼铁的过程是通过置换反应得到铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并有能使品红褪色的气体产生。下列说法错误的是( )

A.S2Cl2为含有极性键和非极性键的非极性分子
B.S2Cl2的结构式为Cl-S-S-Cl
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com