
| A�� | ��Na2CO3��Һ��ͨ��CO2����ҺΪ���ԣ���$\frac{c��{{N}_{a}}^{+}��}{2c��C{{O}_{3}}^{2-}��}$��1 | |
| B�� | pH��ͬ�İ�ˮ��Ba��OH��2��Һ��2c��NH4+��=c��Ba2+�� | |
| C�� | ��CH3COONa��Һ��25��������40�棬��Һ��$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��•c��O{H}^{-}��}$���� | |
| D�� | ��Mg��OH��2��Һ�м�������NH4Cl��ĩ��$\frac{c��M{g}^{2+}��}{c��O{H}^{-}��}$���� |
���� A�������Һ�����ԣ���c��OH-��=c��H+������Һ�д��ڵ���غ㣬���ݵ���غ��c ��Na+��=2c �� CO32-��+c��HCO3-����
B��pH��ͬ�İ�ˮ��Ba ��OH��2��Һ��c��OH-����c��H+���ֱ���ȣ����ݵ���غ��жϣ�
C����CH3COONa��Һ��25��������40�棬�ٽ�ˮ��ƽ��������У�
D���Ȼ�林ٽ�������þ�ĵ��룮
��� �⣺A�������Һ�����ԣ���c��OH-��=c��H+������Һ�д��ڵ���غ㣬���ݵ���غ��c ��Na+��=2c �� CO32-��+c��HCO3-��������$\frac{c��N{a}^{+}��}{2c��C{{O}_{3}}^{2-}��}$��1����A��ȷ
B��pH��ͬ�İ�ˮ��Ba ��OH��2��Һ��c��OH-����c��H+���ֱ���ȣ����ݵ���غ��c ��NH4+��=2c �� Ba2+������B����
C����CH3COONa��Һ��25��������40�棬�ٽ�ˮ��ƽ��������У�ƽ�ⳣ��������$\frac{c��C{H}_{3}COOH��}{c��C{H}_{3}CO{O}^{-}��c��O{H}^{-}��}$��ֵ��ƽ�ⳣ���ĵ�������ֵ��С����C����
D����Mg��OH��2��Һ�м�������NH4Cl��ĩ���ܽ��������þ�����������������笠����ӷ�Ӧ������þ����Ũ����������������Ũ�ȼ�С������$\frac{c��M{g}^{2+}��}{c��O{H}^{-}��}$����D����
��ѡA��
���� ���⿼������Ũ�ȴ�С�Ƚϣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������ж���������ȷ��Һ�����ʳɷּ������ʡ���Һ������ǽⱾ��ؼ���ע�����غ㡢�����غ㼰�����غ��������ã��״�ѡ����D����Ŀ�Ѷ��еȣ�


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3mol/L | B�� | 2mol/L | C�� | 1mol/L | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
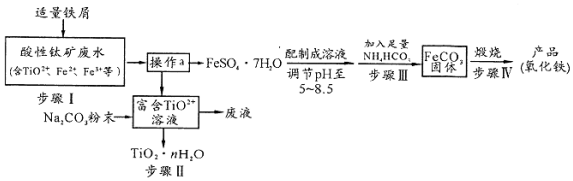
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | a |
| c��CO2�� | 3 | 1 | 0.8 | 1 |
| c��H2�� | 2 | 1 | 0.8 | 1 |
| c��CO�� | 1 | 2 | 3 | 0.5 |
| c��H2O�� | 2 | 2 | 3 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��lmol H2��1molCl2���ջ��ȼ��IJ��� | |
| B�� | 6.02��1023��HCl������� | |
| C�� | �����£���1molHCl����ͨ��100mLˮ��������Һ | |
| D�� | �����£�73gHCl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ������ | C�� | �������������� | D�� | ԭ������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com