
用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是
| A.苯中的苯酚(Br2水、过滤) |
| B.乙酸乙酯中的乙酸(饱和碳酸钠溶液、分液) |
| C.溴乙烷中的乙醇(水、分液) |
| D.溴苯中的溴(NaOH溶液、分液) |
A
解析试题分析:A中苯酚和溴水反应生成的三溴苯酚能溶解在苯中,应该用氢氧化钠溶液,分液;B中的饱和碳酸钠溶液能吸收乙酸,降低乙酸乙酯的溶解度,可以实现分离,B正确;溴乙烷不溶于水,乙醇和水互溶,可以实现分离,C正确;D中的溴单质能被氢氧化钠溶液吸收,而溴苯不溶于水,可以实现分离,D正确,答案选A。
考点:考查物质的分离与提纯
点评:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
用下列装置不能达到实验目的的是
| A.用甲图装置比较NaHCO3和Na2CO3的热稳定性 |
B.用乙图装置制备 |
| C.用丙图装置制备并收集少量NO2气体 |
| D.用丁图装置制取少量金属锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:
①H2 ②Cl2③CH4④HCl⑤NH3⑥NO⑦NO2⑧SO2,下列操作正确的是 ( )
| A.烧瓶是干燥的,由A进气收集①③⑤ |
| B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧ |
| C.在烧瓶中充满水,由A进气收集①③⑤⑦ |
| D.在烧瓶中充满水,由B进气收集⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关下图所示装置的叙述不正确的是 
① ② ③ ④
| A.装置①可用于吸收实验中多余的Cl2 |
| B.装置②可用于收集H2、NH3、Cl2、NO2等 |
| C.装置③中X为汽油,可用于吸收氨气或氯化氢 |
| D.装置④可用于收集NH3,并吸收多余NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验不能达到预期目的的是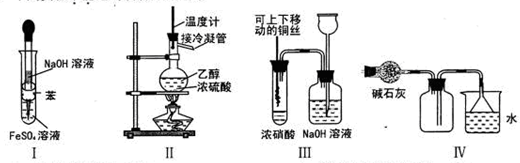
| A.利用I制取Fe(OH)2 | B.利用II装置制取CH2=CH2 |
| C.利用III装置进行铜与浓硝酸反应的实验 | D.利用IV装置收集NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: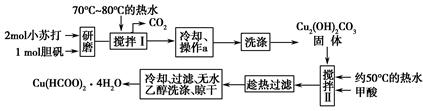
回答下列问题:
(1)小苏打水溶液显________性(填“酸”、“碱”或“中”)可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为________________________。
(2)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为________________________。
(3)操作a的名称是________,该操作使用的玻璃仪器有________。
(4)证明碱式碳酸铜已经洗涤充分的实验操作是___________________________________。
(5)用无水乙醇洗涤晶体的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: 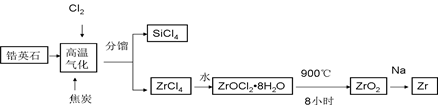
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2?8H2O在900℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选);
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是 。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是 ;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl; 。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-;③I2+SO32-+H2O 2I-+SO42-+2H+)
则滴定过程中可用 作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com