
 .
.
分析 (1)键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,利用H原子饱和C的四价结构,杂原子及杂原子上的H原子需要标出,据此书写;
(2)①依据水浴加热优点解答;
②溴乙烷在NaOH乙醇溶液中发生的是消去反应生成乙烯;乙烯中含有乙醇,可以用水除去乙醇;乙烯能使高锰酸钾溶液褪色.
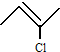
解答 解:(1)2-氯-2-丁烯,主链有4个碳原子,2号碳上有1个氯原子,2号碳上有1个碳碳双键,其键线式为: ;
;
故答案为: ;
;
(2)①用水浴加热热均匀,减少溴乙烷的损失;
故答案为:使反应物均匀受热;
②溴乙烷在NaOH乙醇溶液中发生的是消去反应生成乙烯,实验中需要检验的产物是乙烯,乙烯中含有乙醇,可以用水除去乙醇;乙烯能使高锰酸钾溶液褪色;故答案为:乙烯或CH2=CH2;除去乙烯中的乙醇,防止干扰乙烯的检验;酸性高锰酸钾溶液褪色;
故答案为:乙烯; 除去乙烯中的乙醇,防止干扰乙烯的检验; 酸性高锰酸钾溶液紫红色褪去.
点评 本题考查了有机物的键线式表示方法,卤代烃的结构与性质,注意溴乙烷发生取代反应,生成乙醇与氢溴酸,发生消去反应,生成乙烯和氢溴酸,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | D. | c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 件下进行):
件下进行):| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol•Lˉ1 KI溶液 | H2O | 0.01 mol•Lˉ1 X 溶液 | 0.1 mol•Lˉ1 双氧水 | 1 mol•Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在外加电场的作用下,胶体发生电泳现象,说明胶体是带电荷的 | |
| B. | 水的沸点比硫化氢的沸点高,是因为水分子内形成了氢键 | |
| C. | 晶体中有阴离子就一定有阳离子 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.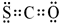 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
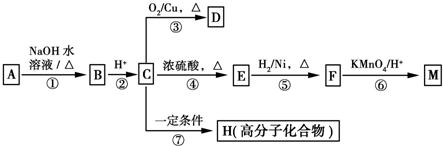
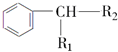 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$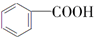 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)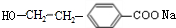 .
.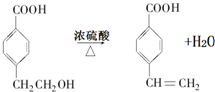 .
.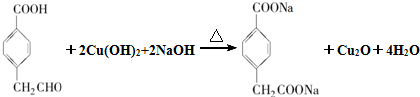 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com