
����Ŀ����Ҫ����գ�
��1������������HOCH2CH2CHO_____��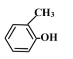 ________��
________��
��2��ȼ��ij�л���A 1.50 g������1.12 L(��״��)CO2��0.05 mol H2O�����л���������Կ���������ܶ���1.04������л���ķ���ʽΪ_____��
��3����֪��Ȳ���ڴ��������¿ɷ���ż����Ӧ:2RC��CH![]() RC��C��C��CR+H2,��ΪGlaser��Ӧ���ش��������⣺
RC��C��C��CR+H2,��ΪGlaser��Ӧ���ش��������⣺
��֪: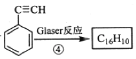 ����ת����ϵ�IJ���E��C16H10���Ľṹ��ʽ��_______����1 mol E�ϳ�1,4���������飬��������Ҫ��������____mol��
����ת����ϵ�IJ���E��C16H10���Ľṹ��ʽ��_______����1 mol E�ϳ�1,4���������飬��������Ҫ��������____mol��
���𰸡�3-�ǻ���ȩ �ڼ����ӣ�2-�����ӣ� CH2O ![]() 4
4
��������
��1���л��ﺬ��3��̼ԭ�ӣ������DZ�ȩ���ǻ�������3��̼ԭ���ϣ����ͷ��ǻ�������λ��ĸ��Ϊ���ӣ���������2��̼ԭ���ϣ�
��2�����л���������Կ���������ܶ���1.04��˵��Ħ������Ϊ29g/mol��1.04=30.16 g/mol��n(CO2)=![]() =0.05mol���л�����̼������m(C)=0.05mol��12g/mol=0.6g���������m(H)=0.05mol��2��1g/mol=0.1g��m(C)+ m(H)<1.5g��˵���л���A�к�����Ԫ�أ���m(O)=1.5g-0.6g-0.1g=0.8g������n(A):n(C):n(H): n(O)ȷ���л���ķ���ʽ��
=0.05mol���л�����̼������m(C)=0.05mol��12g/mol=0.6g���������m(H)=0.05mol��2��1g/mol=0.1g��m(C)+ m(H)<1.5g��˵���л���A�к�����Ԫ�أ���m(O)=1.5g-0.6g-0.1g=0.8g������n(A):n(C):n(H): n(O)ȷ���л���ķ���ʽ��
��3������Glaser��Ӧ�ķ�Ӧԭ��ȷ��E�Ľṹ��![]() �����������ӳɷ�Ӧ��ɵ�1,4���������飻
�����������ӳɷ�Ӧ��ɵ�1,4���������飻
��1���л��ﺬ��3��̼ԭ�ӣ������DZ�ȩ���ǻ�������3��̼ԭ���ϣ���˸��л��������Ϊ3-�ǻ���ȩ�����ͷ��ǻ�������λ��ĸ��Ϊ���ӣ���������2��̼ԭ���ϣ���˸��л��������Ϊ�ڼ����ӻ�2-�����ӣ�
��2���ɷ�����֪�л���A�к�����Ԫ�أ���m(O)=1.5g-0.6g-0.1g=0.8g��n(O)=![]() =0.05mol����n(A)=
=0.05mol����n(A)=![]() =0.05mol�����n(A):n(C):n(H): n(O)=0.05:0.05:0.1:0.05=1:1:2:1�����л���ķ���ʽΪCH2O��
=0.05mol�����n(A):n(C):n(H): n(O)=0.05:0.05:0.1:0.05=1:1:2:1�����л���ķ���ʽΪCH2O��
��3����Ȳ���ڴ������ڷ���Glaser��Ӧ�����ɵ�E�Ľṹ��ʽΪ![]() �� 1,4����������ĽṹΪ
�� 1,4����������ĽṹΪ![]() ,
,![]() ��4molH2������Ӧ�ɵ�
��4molH2������Ӧ�ɵ�![]() ��
��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֹ���Ԫ�أ�����������õĽ������ϡ���ش������й����⣺
��1����ҵ�ϳ�����CO��ԭ����������ұ������
��֪��Fe2O3(s)��3CO(g)=2Fe(s)��3CO2(g) ��H1����25kJ/mol
3Fe2O3(s)��CO(g)=2Fe3O4(s)��CO2(g) ��H2����47kJ/mol
Fe3O4(s)��CO(g)=3FeO(s)��CO2(g) ��H3����19kJ/mol
��д��CO���廹ԭFeO����õ�Fe�����CO2������Ȼ�ѧ��Ӧ����ʽ��_____��
��2��11.2gFe��һ������HNO3��ַ�Ӧ��Feȫ���ܽ⣬����Fe2����Fe3�������ʵ���֮��Ϊ1��4�������ɵ�������һ������O2��Ϻ�ͨ��ˮ���У�����ǡ�ñ���ȫ���գ�O2�����ʵ�����____��
��3�����õ��ʵ������Ƶô�����Fe(OH)2��װ����ͼ��ʾ�����缫�ֱ���ʯī�������������ҺΪNaCl��Һ��
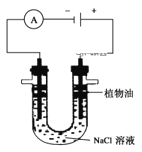
��ֲ���͵�������___���ڼ���ֲ����֮ǰ��Ҫ��NaCl��Һ���δ�����____��
�������ĵ缫��ӦʽΪ____��
��������װ�ø�Ϊ��ֹFe�����绯ѧ��ʴ��װ�ã���Fe�缫Ӧ���Դ____������������·��ͨ��2mol����ʱ���������ռ�������___L(��״��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������£�������������Һ��
��0.1 mol/L NH4Cl
��0.1 mol/L CH3COONH4
��0.1 mol/L NH4HSO4
��0.1 mol/L NH3��H2O��0.1 mol/L NH4Cl���Һ
��0.1 mol/L NH3��H2O
�����Ҫ����д���пհף�
��1����Һ�ٳ�_____��(��ᡱ������С�)����ԭ����____________(�����ӷ���ʽ��ʾ)��
��2����Һ�٢ڢۢ���c(NH4+)�Ĺ�ϵ�ɴ�С������______�����â٢ڢۢݱ�ʾ��
��3�������£������Һ�ڵ�pH��7����CH3COO����NH4+Ũ�ȵĴ�С��ϵ��c(CH3COO��)________c(NH4+)(���������������)��
��4����֪������NH3��H2O�ĵ��볣��Ϊ1.8��10��5��ͨ���������֪��Һ�ܳ�____��(��ᡱ������С�)����Һ������Ũ����С����Ϊ____________�������ӷ��ű�ʾ�������¶���1 mol��L��1��NH4Cl��Һ��c(H��)��_____ mol��L��1��(��֪![]() ��2.36)��
��2.36)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڽ����ơ�������Ͷ�����(Na2Sx)�ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մ�(�ɴ���Na��)Ϊ����ʣ��䷴Ӧԭ����ͼ��ʾ������˵����ȷ����

A����������A�缫���õ�����B�缫������ʡ�A �缫
B�����ʱ���缫B����ӵ�Դ�����������缫��ӦʽΪ Sx2-��2e��=xS
C�����øõ���������϶�п��������Ӧ��B�缫������
D�����øõ�ص�⾫��ͭ����·��ת��1mol����ʱ��������������32 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���Ի�ͭ��(��Ҫ�ɷ�ΪCu2S��������SiO2��Ϊԭ���Ʊ�����ͭ�Ĺ���������ͼ��ʾ��

��1��д������ȡ��������Cu2S�ܽ�ʱ������Ӧ�����ӷ���ʽ��___��
��2�����¡���ȡ���Ĺ����з���ͭԪ�صĽ�ȡ�������������٣����о�ָ��CuCl2�Ǹ÷�Ӧ�Ĵ������ù��̵ķ�Ӧԭ�����û�ѧ����ʽ��ʾΪ����Cu2S +2CuCl2=4CuCl+S����___��
��3��������S���������¶ȿ�����50��60��֮�䣬���˹��ߵ�ԭ����___��
��4������ҺM�м���(��ͨ��)___(����ĸ)���ɵõ�һ�ֿ�ѭ�����õ����ʡ�
a.�� b.���� c.������� d.�Ȼ���
��5�������³����������У�����CuO��Ŀ����__��������Ũ������ȴ�ᾧ�������У�Ҫ��HNO3��Һ������Һ��pH��������_��
��6����ͭ����ɻ�ͭ��(��Ҫ�ɷ�ΪCuFeS2)ͨ���绯ѧ��Ӧת����ɣ��й�ת����ͼ��ת��ʱת��0.2mol���ӣ�����Cu2S___mol��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���CH3COONaϡ��Һ�зֱ���������������ʣ�
������NaOH��������KOH��������NaHSO4��������CH3COONa����������
����һ����ʹc��CH3COO-��/c��Na+����ֵ������� (����)
A. �٢� B. �ڢ� C. �٢� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�![]() ��
��![]() ��
��![]() �ȵĴ��������Ի�����������Ҫ���塣
�ȵĴ��������Ի�����������Ҫ���塣
��1����ѧ�������о����ô�������β���е�NO��COת���![]() ��
��![]() ���䷴ӦΪ��
���䷴ӦΪ��![]()
![]()
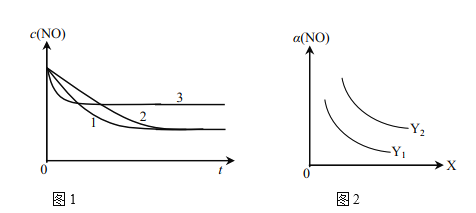
��Ϊ���о���������Ը÷�Ӧ��Ӱ�죬�����±�����ʵ�飬��ò�ͬʱ��NO��Ũ�ȣ�c����ʱ��仯��������ͼ1��ʾ��1��2��3������ʵ����������________������֪��ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ���
ʵ���¶�NO��ʼŨ��O��ʼŨ�ȴ����ȱ��������������ţ��棩
ʵ�� ��� | �¶� ���棩 | NO��ʼŨ��
| CO��ʼŨ��
| �����ȱ����
| �������� ��g�� |
�� | 280 |
|
| 82 | 50 |
�� | 280 |
|
| 124 | 50 |
�� | 350 |
|
| 124 | 50 |
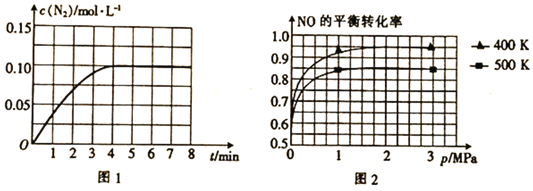
��ͼ2��ʾNO��ƽ��ת���ʣ�a�����¶ȡ�ѹǿ�仯��ʾ��ͼ��X��ʾ����________��������________��Y��ʾ����________����Y1________Y2������>������<������
��2��һ���¶��£���![]() ��
��![]() �������1��2�����ܱ������з�����Ӧ
�������1��2�����ܱ������з�����Ӧ![]() ���ﵽƽ��ʱ
���ﵽƽ��ʱ![]() ���������Ϊ25�����÷�Ӧ��ƽ�ⳣ��
���������Ϊ25�����÷�Ӧ��ƽ�ⳣ��![]() ________��
________��
��3������ԭ��ط�Ӧ��ʵ��![]() ���������ܷ�ӦΪ
���������ܷ�ӦΪ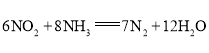 ���������ҺΪ���ԡ�����һ��ʱ��õ�ظ�����������ҺpH________�����������������С���������������������缫��ӦʽΪ________��
���������ҺΪ���ԡ�����һ��ʱ��õ�ظ�����������ҺpH________�����������������С���������������������缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ����������ȷ���� ��������
A.H2��ȼ����Ϊ285.8 kJ��mol-1����H2O�������H2��O2���Ȼ�ѧ����ʽΪ2H2O��l��=2H2��g��+O2��g����H=+285.8 kJ��mol-1
B.1 mol CH4��ȫȼ������CO2��g����H2O��l��ʱ�ų�890 kJ������,���Ȼ�ѧ����ʽΪ![]() CH4��g��+O2��g��=
CH4��g��+O2��g��= ![]() CO2��g��+H2O��l������H=-445 kJ��mol-1
CO2��g��+H2O��l������H=-445 kJ��mol-1
C.��֪H2��g��+Cl2��g��=2HCl��g������H=-Q��Q>0�� kJ��mol-1����H2��ȼ����ΪQ kJ��mol-1
D.HF��NaOH��Һ��Ӧ��H+��aq��+OH-��aq��=H2O��l������H=-57.3 kJ��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.2017��5��5�գ��й��ܰ��չ��ʱ����Ƶ�ӵ������֪ʶ��Ȩ�Ĵ��Ϳͻ�C-919���Ϻ��ֶ������ɣ���ѧ����ʵ�������о������ô��������ɻ�β���е�NO��COת���CO2��N2�ķ�ӦΪ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H<0��
N2(g)+2CO2(g)��H<0��
(1)����1mol NO��2mol COͨ��2L�ĺ����ܱ������У���һ�������·���������Ӧ����Ӧ�����ɵ�N2�����ʵ���Ũ����ʱ��ı仯�����ͼ1��ʾ����NO�ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NO)=__________��4minĩCO��Ũ��Ϊ__________mol��L-1��
(2)��֪������Ӧ��NO��ƽ��ת������ѹǿ���¶ȵĹ�ϵ��ͼ2��ʾ����ҵ�ϴ�װ���бȽ��ʺϵ��¶Ⱥ�ѹǿ��__________
II.ȡ50 mL0.50mol��L-1NaOH��Һ��50 mL��0.50mol/L������Һ�����к��Ȳⶨʵ�飬ʵ���������±���
(1)����д���еĿհף�
�¶� ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ��t2-t1��/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 31.4 | |
(2)������Ϊ0.50mol��L-1 NaOH ��Һ��0.50mol��L-1������Һ���ܶȶ���1g��cm-3���кͺ�������Һ�ı�����c =4.18J��g-1����-1�����к�����H=__________��(ȡС�����һλ)
(3)����ʵ����ֵ�����57.3kJ��mol-1��ƫ�����ƫ���ԭ�������__________������ĸ����
a.ʵ��װ�ñ��¡�����Ч����
b.��ȡNaOH��Һ�����ʱ���Ӷ���
c.�ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d.���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com