
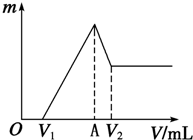
 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴加1mol?L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴加1mol?L-1的NaOH溶液.请回答:| n |
| c |
| n |
| c |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.44mol |
| 1mol/L |
| 0.4mol |
| 1mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、全部 | B、①②③④⑤ |
| C、③④⑤⑥ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在托盘天平上放两片大小一样的纸,然后将氯化钠放在纸片上称量 |
| B、把称得的氯化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中 |
| C、用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中 |
| D、沿玻璃棒往容量瓶中加入蒸馏水,直至溶液凹液面恰好与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物分子中C、H、O原子个数比为1:2:3 |
| B、分子中碳、氢原子个数比为1:2 |
| C、有机物中必定含有氧元素 |
| D、有机物中肯定不含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖 | B、碱 | C、盐 | D、亚硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
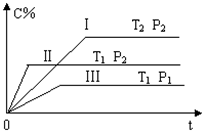 在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:
在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:| A、T1>T2,Q<0 |
| B、T1<T2,Q>0 |
| C、P1>P2,x=1 |
| D、P1<P2,x≠1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com