
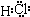 ,故答案为:H2O2;
,故答案为:H2O2;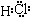 ;
; 2KOH+Cl2↑+H2↑.当溶液的pH=13时,溶液中c(KOH)=0.1mol/L,所以n(KOH)=0.1mol/L×1L=0.1mol,由电解方程式可知,生成氯气的物质的量为0.05mol,氯气体积为0.05mol×22.4L/mol=1.12L.将上述两电极材料调换,Fe为活性电极,在阳极上放电,生成亚铁离子,阳极上的电极反应为 Fe-2e-=Fe2+,
2KOH+Cl2↑+H2↑.当溶液的pH=13时,溶液中c(KOH)=0.1mol/L,所以n(KOH)=0.1mol/L×1L=0.1mol,由电解方程式可知,生成氯气的物质的量为0.05mol,氯气体积为0.05mol×22.4L/mol=1.12L.将上述两电极材料调换,Fe为活性电极,在阳极上放电,生成亚铁离子,阳极上的电极反应为 Fe-2e-=Fe2+, 2KOH+Cl2↑+H2↑;1.12L;Fe-2e-=Fe2+;
2KOH+Cl2↑+H2↑;1.12L;Fe-2e-=Fe2+;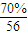 :
: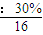 =2:3,所以化合物K为Fe2O3,铝与氧化铁反应生成氧化铝与铁,反应的化学方程式是 Fe2O3+2Al
=2:3,所以化合物K为Fe2O3,铝与氧化铁反应生成氧化铝与铁,反应的化学方程式是 Fe2O3+2Al Al2O3+2Fe,
Al2O3+2Fe, Al2O3+2Fe;
Al2O3+2Fe;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

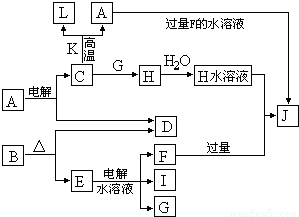
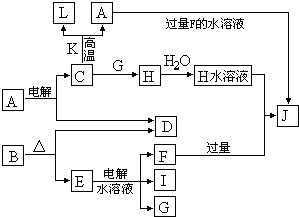
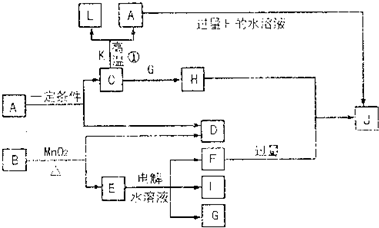
请填空:?
(1)D的元素与I的元素能形成原子个数比为1∶1的共价化合物,其电子式为 。?
(2)写出用石墨作电极,电解E水溶液的离子方程式 。气体G在 极逸出(填“阳”或“阴”)。?
(3)写出C+K→L+A的化学方程式 ,指出引发此反应的方法: 。
(4)写出A+F→J的离子方程式 。?
查看答案和解析>>
科目:高中化学 来源: 题型:
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F →J的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010届辽宁省大连协作体高二上学期竞赛(理综)化学部分 题型:填空题
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成 原子个数比为1:1的共价化合物,请写出其分子式: ;
原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com