
通过对CO和C02的学习,你认为下列观点中不正确的是( )
A.物质的结构决定物质的性质
B.物质的性质决定物质的用途
C. 气体的性质决定气体的收集方法
D.物质的组成元素相同,则化学性质一定相同
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下)
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
CH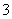 、—CH3、CH
、—CH3、CH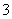 都是重要的有机反应中间体,有关它们的说法不正确的是
都是重要的有机反应中间体,有关它们的说法不正确的是
A.它们均由甲烷去掉一个氢原子所得
B.CH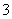 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
C.CH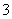 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D.两个—CH3或一个CH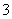 和一个CH
和一个CH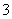 结合均可得到CH3CH3
结合均可得到CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
除去CO中混有的少量CO2,下列方法中正确的是( )
A.  将混合气体点燃 B. 通入灼热的氧化铜中
将混合气体点燃 B. 通入灼热的氧化铜中
C. 将混合气体通入稀盐酸中 D. 将混合气体通入澄清的石灰水中
将混合气体通入澄清的石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
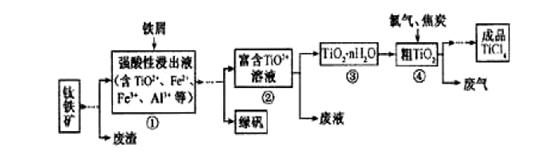
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
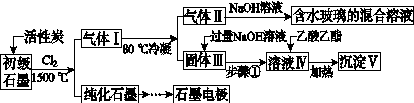
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是____________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为________。由气体Ⅱ中某物得到水玻璃的化学反应方程式为____________________________________________。
(3)步骤①为:搅拌、________。所得溶液Ⅳ中的阴离子有________。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为______________________________________________,100 kg初级石墨最多可能获得Ⅴ的质量为______kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
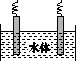
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com