
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
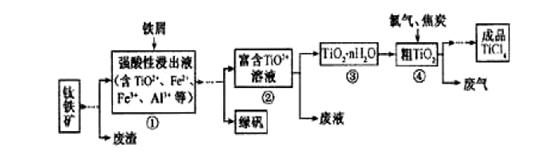
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |

【解析】(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+” 。
。
(2)形成TiO2·n H2O溶胶,说明得到是胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm~100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe (OH)3+3H+ Fe3+ +H2O的平衡常数K=
Fe3+ +H2O的平衡常数K=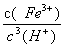 =
=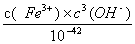 =
=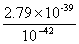 =2.79×103。
=2.79×103。
此问设计精妙!利用数学关系巧妙代换求出反应的平衡常数,命题者的独具匠心可见一斑。
(4)涉及盖斯定律计算,比较常规,按要求写出方程式相加即可得出【答案】
TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)下表信息可以看出,SiCl4、TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
这题是典型的化工流程题,问题设置不难。第(3)小问是亮点,精妙!个人觉得加上请计算该反应的平衡常数K可能设问更清晰。
【答案】(1)使Fe3+还原为Fe2+;生成Ti3+保护Fe2+不被氧化。
(2)10-9m~10-7m(或其他合理答案);
(3)2.79×103;
(4)TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1;
(5)产生三废(或其他合理答案);
(6)蒸馏(或分馏,或精馏)。



科目:高中化学 来源: 题型:
氯原子对O3分解有催化作用:
O3 + Cl =ClO + O2 ΔH1 ClO + O =Cl + O2 ΔH2
大气臭氧层的分解反应是:O3 + O=2O2 ΔH,该反应的能量变化如图:

下列叙述中,正确的是( )
A.反应O3 + O =2O2的ΔH=E1-E3 B.O3 + O =2O2是吸热反应
C.ΔH=ΔH1+ΔH2 D.大气层中的臭氧无法再生
查看答案和解析>>
科目:高中化学 来源: 题型:
通过对CO和C02的学习,你认为下列观点中不正确的是( )
A.物质的结构决定物质的性质
B.物质的性质决定物质的用途
C. 气体的性质决定气体的收集方法
D.物质的组成元素相同,则化学性质一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
从H、O、C、Ca四种元素中,选择适当的元素组成符合下列要求的一种物质,并
用化学式填空。
(1)具有可燃性,可做火箭燃料的是 。
(2) 相对分子质量最小的氧化物是 。
相对分子质量最小的氧化物是 。
(3)大理石或石灰石的主要成分都是  。
。
(4)可做温室肥料,固体可用于人工降雨的是 。
(5)农业上可供用来改良酸性土壤的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
A、将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C 、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D、将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体

查看答案和解析>>
科目:高中化学 来源: 题型:
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。

已知:
① 反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
② I是一种常见的温室气体,它和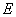 可以发生反应:2E+I
可以发生反应:2E+I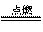 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________________;
(2)化合物Ⅰ的电子式为______________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出离子方 程式和计算过程);
程式和计算过程);
(4)C与过量NaOH溶液反应的离子方程式为___________________________,反应后溶液与过量化合物Ⅰ反应的离子方程式为_______________________________;
(5)E在I中燃烧观察到的现象是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少 D.甲中和乙中的沉淀可能一样多

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com