
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。

已知:
① 反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
② I是一种常见的温室气体,它和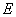 可以发生反应:2E+I
可以发生反应:2E+I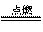 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________________;
(2)化合物Ⅰ的电子式为______________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出离子方 程式和计算过程);
程式和计算过程);
(4)C与过量NaOH溶液反应的离子方程式为___________________________,反应后溶液与过量化合物Ⅰ反应的离子方程式为_______________________________;
(5)E在I中燃烧观察到的现象是__________________________。

科目:高中化学 来源: 题型:
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个热化学方程式__________________________________________。
(2)家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,则丁烷的燃烧热ΔH=___________。已知1 mol液态水汽化时需要吸收44 kJ的热量,则反应:C4H10(g)+ O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,建中b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。

查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
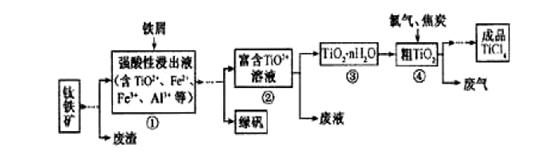
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
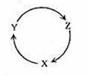
下列各组物质中,满足下图物质一步转化关系的选项是
|
| X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO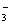 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② …… | 若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3 )3溶液中的Fe3+和NO
)3溶液中的Fe3+和NO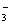 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
答案(1)ade
(2)Fe3++Ag= Fe2++Ag+
(3)①将银镜在硝酸铜溶液中
(4)同意 4Fe3++6H2O+9Ag+3NO3-=4Fe(OH)3+9Ag++3NO

查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH溶液、 浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、 浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
54.某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸 mL(保留两位小数)。
55.某溶液组成如表一:
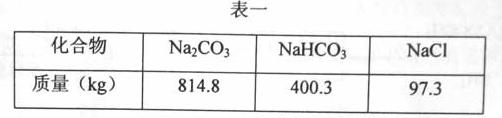
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:

计算析出的碳酸氢纳晶体的质量(保留1位小数)。
56.将组成如表二的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回到表一状态。计算补加的碳酸纳质量(保留1位小数)。
57.某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com