
【题目】某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:
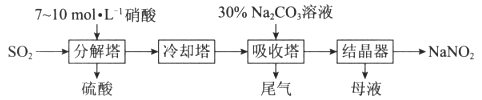
已知:Na2CO3+NO+NO2===2NaNO2+CO2
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是_____________________________。
(2)“分解塔”中的温度不宜过高,其原因是_____________________________________________。
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则“分解塔”中发生反应的化学方程式为______________________________________________。
(4)“分解塔”中的硝酸浓度不宜过大的原因是___________________________________________。
(5)为提高氮氧化物的转化率,可向“尾气”中通入一定量的________气体,再通入“吸收塔”中,实现循环吸收。
(6)“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为________(填化学式)。
【答案】使SO2气体被充分吸收硝酸受热会挥发、分解2HNO3+2SO2+H2O===NO+NO2+2H2SO4硝酸浓度过大,氮氧化物中NO2含量高,导致亚硝酸钠产率降低(或硝酸钠含量过高)O2NaHCO3
【解析】
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,采取逆向吸收,接触更充分,吸收效果更好,故答案为:使SO2气体被充分吸收;
(2)因硝酸不稳定,受热易分解,“分解塔”中的温度不宜过高,故答案为:硝酸受热会挥发、分解;
(3)由题给信息可知反应物为硝酸和二氧化硫,生成物为物质的量之比为1:1的NO与NO2、硫酸等,则反应的方程式为:2HNO3+2SO2+H2O===NO+NO2+2H2SO4,故答案为:2HNO3+2SO2+H2O===NO+NO2+2H2SO4;
(4)浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,故当硝酸浓度过大,主要还原生成NO2,导致亚硝酸钠产率降低;若硝酸浓度过低,分解塔中出来的主要是NO,亚硝酸钠产率也低;故答案为:硝酸浓度过大,氮氧化物中NO2含量高,导致亚硝酸钠产率降低(或硝酸钠含量过高);
(5)吸收塔中尾气的成分主要是NO和NO2,故可以通入适量的O2,再进入吸收塔,循环吸收,故答案为:O2;
(6)由碳酸钠与酸反应的原理可知“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有NaHCO3,故答案为:NaHCO3。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00 mL,分离并测定Fe3+的浓度,实验方案设计如下:
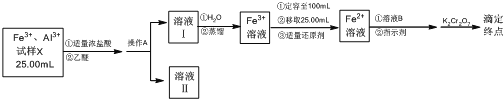
已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5 ℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是____________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案___________。
(3)滴定前,加入的适量溶液B是________。
A.H2SO3H3PO4 B.H2SO4H3PO4 C.HNO3H3PO4 D.HIH3PO4
(4)滴定达到终点时,消耗0.100 0 mol·L-1 K2Cr2O7溶液6.00 mL。根据该实验数据,试样X中c(Fe3+)为________。
(5)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是________。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Zn+2HCl=ZnCl2+H2的反应,下列说法正确的是( )
A.单质Zn中Zn的化合价升高,被还原,是氧化剂
B.HCl中H的化合价降低,被氧化,HCl是还原剂
C.H2是还原产物
D.该反应是复分解反应,也是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称________、________、________。
(2)C在元素周期表中的位置是____________________。
(3)B的原子结构示意图为________________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径A________C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CN)2、(OCN)2等被称为拟卤素,(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2)。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。写出外界离子基态核外电子排布式:________________。
(2)与OCN-互为等电子体的分子为________(填分子式)。
(3)1 mol(CN)2中含有π键的数目为________。
(4)乙二胺中C原子的轨道杂化方式为________。
(5)乙二胺易溶于水,除因为是极性分子外,还可能的原因为________。
(6)含CN-的配合物常用于冶炼黄金。金的晶胞结构如下图所示,晶体中每个Au原子周围紧邻且等距的Au原子有________个。
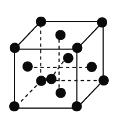
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是由有机物X加聚制得的热塑性塑料,为透明如玻璃状的无色固体,可用以制造航空窗玻璃、仪表盘、外科照明灯、装饰品和生活用品等.其结构简式为: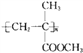 请回答下列问题:
请回答下列问题:
(1)写出X的结构简式_____________________;
(2)有机物X不能发生的反应有________(填写序号);
①和氢气加成 ②使溴水褪色 ③被酸性高锰酸钾溶液氧化 ④水解反应 ⑤酯化反应
(3)有机物X有多种同分异构体,其中含有2个甲基且属于羧酸类的有机分子的结构简式为________________________________(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com