(2010?四川)四川攀枝花蕴藏丰富的钒、钛、铁资源.用钛铁矿渣(主要成分为TiO
2、FeO、Fe
2O
3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如图:
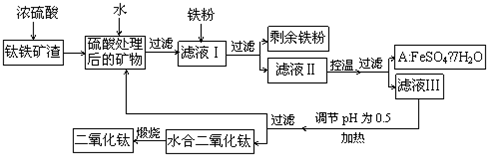
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是
TiO2+2H2SO4=Ti2(SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O
TiO2+2H2SO4=Ti2(SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O
.
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为:
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
、
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解.水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀.请用所学化学平衡原理分析通入高温水蒸气的作用:
加入促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解
加入促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解
.过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、
H2O
H2O
、
FeSO4
FeSO4
、
H2SO4
H2SO4
(填化学式),减少废物排放.
(4)A可用于生产红色颜料(Fe
2O
3),其方法是:将556akgA(摩尔质量为278g/mol)溶于水中,加入过量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体,再向红褐色胶体中加入3336bkgA和112ckg铁粉,鼓入足量空气搅拌,反应完全后,有大量Fe
2O
3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料,若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料
160a+320b+160c
160a+320b+160c
kg.




 硫酸生产过程中关键阶段的反应为:
硫酸生产过程中关键阶段的反应为: