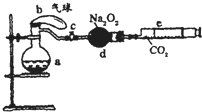
��2008?����һģ����ͼ��ʾװ���У�a��ʢ�б�״���µĿ���������ռ
����10mL 1.2mol/L�����250mL��ƿ��b��δ������ʵ�鿪ʼǰ�ڲ�û�����壩����0.384gͭ�۵�����c�Ǽн��˵��ɼУ�d��ʢ�������Ĺ������ƣ�e�dz��ж�����̼����ͭ������װ���Ѿ��������Լ��ϸ�
��1���������е�ͭ��С�ĵ�����ƿ�У���ַ�Ӧ����ͭ����ʣ�ࣨ����������岻�ܽ�����Һ�У�����ɹ۲쵽��������
��Һ����ɫ����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
��Һ����ɫ����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
��
��2�������ͭ�����ᷴӦ�����ʿɲ��ö��ֲ�ͬ�Ĵ�ʩ�����ü��뻯ѧ�Լ����������Լ��п���ѡ�õ���
D
D
��
A������ˮ B����ˮ������ C��ͭ�� D��������������Һ
��3������ƿ����������������С����Ӧ�Ļ�ѧ����ʽ��
4NO2+O2+2H2O=4HNO3 ��4NO+3O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3 ��4NO+3O2+2H2O=4HNO3
����ʱ������ȫ������ƿ���һ���ֽ�����ƿ��
��һ���ֱ�������ƿ
��һ���ֱ�������ƿ
��
��4�����ɼ�c����������̼���������ڣ���������ƿ��ʹ���������塢��Һ��ֽӴ�����ʹ���е�ͭ��ȫ�ܽ⣬������Ҫ���������̼
38.4
38.4
mL��
��5��������������һ���ܵĻ�ѧ����ʽ��ʾ
2Cu+4HNO3+O2=2Cu��NO3��2+2H2O
2Cu+4HNO3+O2=2Cu��NO3��2+2H2O
��




 ��2008?����һģ����ͼ��ʾװ���У�a��ʢ�б�״���µĿ���������ռ
��2008?����һģ����ͼ��ʾװ���У�a��ʢ�б�״���µĿ���������ռ