
| A. | 硝酸银和氯化钠的混合溶液 | B. | 硫酸铜和硫酸钾的混合溶液 | ||
| C. | Na2CO3和NaOH混合溶液 | D. | CuCl2和HCl混合溶液 |
分析 A.以石墨为电极,电解等体积、等物质的量浓度的硝酸银和氯化钠的混合溶液,二者反应方程式为AgNO3+NaCl=NaNO3+AgCl↓,实质上是电解NaNO3溶液,电池反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
B.以石墨为电极,电解等体积、等物质的量浓度的硫酸铜和硫酸钾的混合溶液,二者不反应,实质上是电解硫酸铜溶液,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,当硫酸铜完全电解后就电解水;
C.以石墨为电极,电解等体积、等物质的量浓度的Na2CO3和NaOH混合溶液,二者不反应,实质上是电解水,电池反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
D.以石墨为电极,电解等体积、等物质的量浓度的CuCl2和HCl混合溶液,二者不反应,实质上是电解CuCl2溶液,电池反应式为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,当氯化铜完全电解后电解HCl.
解答 解:A.以石墨为电极,电解等体积、等物质的量浓度的硝酸银和氯化钠的混合溶液,二者反应方程式为AgNO3+NaCl=NaNO3+AgCl↓,实质上是电解NaNO3溶液,电池反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阴、阳两极收集到的气体体积不可能相等,故A错误;
B.以石墨为电极,电解等体积、等物质的量浓度的硫酸铜和硫酸钾的混合溶液,二者不反应,实质上是电解硫酸铜溶液,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,当硫酸铜完全电解后就电解水,则阴、阳两极收集到的气体体积可能相等,故B正确;
C.以石墨为电极,电解等体积、等物质的量浓度的Na2CO3和NaOH混合溶液,二者不反应,实质上是电解水,电池反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阴、阳两极收集到的气体体积不可能相等,故C错误;
D.以石墨为电极,电解等体积、等物质的量浓度的CuCl2和HCl混合溶液,二者不反应,实质上是电解CuCl2溶液,电池反应式为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,当氯化铜完全电解后电解HCl,电解HCl时阴阳极得到的气体一样多,当氯化铜、HCl完全电解后就电解水,所以阴、阳两极收集到的气体体积可能相等,故D正确;
故选BD.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质成分及离子放电顺序是解本题关键,注意加入的两种物质可能发生反应导致混合溶液中溶质改变,易错选项是A.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
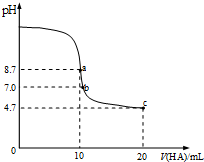
| A. | a点所示溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) | |
| B. | a~b段溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) | |
| C. | pH=7时的溶液中:c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中:c(HA)>c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
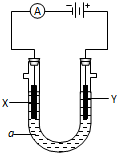 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,2.24LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9gNa2O2晶体中所含的离子总数 | |
| D. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
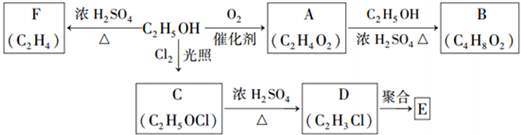
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com