
【题目】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2OH3O++OH﹣ , 则液态NH3电离的方程式是
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= , 在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=
(3)25℃时,0.1mol/L的HA溶液中 ![]() =1010 . 请回答下列问题:
=1010 . 请回答下列问题:
①HA是(填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是(填字母)
A.c(HA) B. ![]() C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3 , 则三种关系为(用“V1、V2、V3”和“>、<、=”表示).
(5)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 . (填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是 , 反应所用时间长短关系是
【答案】
(1)2NH3?NH4++NH2﹣
(2)1×10﹣12;10:1
(3)弱电解质;D
(4)V2>V3=V1
(5)B>A=C;A=B=C;A=C>B
【解析】解:(1)依据2H2OOH﹣+H3O+ , 可知液体氨气部分电离出铵根离子和氨基负离子,电离方程式:2NH3NH4++NH2﹣;所以答案是:2NH3NH4++NH2﹣;(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的氢氧根离子的浓度为:10﹣2mol/L,而pH=10,说明溶液中氢离子的浓度为:10﹣10mol/L,所以该温度下水的KW=10﹣2mol/L×10﹣10mol/L=1×10﹣12;混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,pH=b的NaOH溶液中氢氧根离子浓度=10b﹣12 mol/L,pH=a的H2SO4溶液氢离子浓度=10﹣a mol/L,
10b﹣12 mol/L×VbL=10﹣a mol/L×VaL且且a+b=13,则Va:Vb=10:1,
所以答案是:1×10﹣12;10:1;(3)25℃时,0.1mol/L的HA溶液中中 ![]() =1010 , 则c(H+)=1.0×10﹣2mol/L,c(OH﹣)=1.0×10﹣12mol/L,说明HA是弱酸,NaA溶液显碱性,将含0.1molHA的溶液用NaOH溶液滴定至中性,耗NaOH的物质的量小于0.1mol,所以答案是:弱电解质;
=1010 , 则c(H+)=1.0×10﹣2mol/L,c(OH﹣)=1.0×10﹣12mol/L,说明HA是弱酸,NaA溶液显碱性,将含0.1molHA的溶液用NaOH溶液滴定至中性,耗NaOH的物质的量小于0.1mol,所以答案是:弱电解质;
②A、n(H+)和n(A﹣)增大,n(HA)减小,所以c(HA)减小,故A错误;
B、平衡常数只受温度影响,所以 ![]() 不变,故B错误;
不变,故B错误;
C、水的离子积常数只受温度影响,c(H+)与c(OH﹣)的乘积不变,故C错误;
D、弱酸HA加水稀释,溶液酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,故D正确;
所以答案是:D;(4)等体积、等pH的Ba(OH)2、NaOH中,c(OH﹣)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3 ,
但NH3H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3 ,
所以消耗酸的体积关系为:V2>V3=V1 ,
所以答案是:V2>V3=V1;(5)醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是:B>A=C,
所以答案是:B>A=C;
②反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间大小为:A=C>B,
所以答案是:A=B=C;A=C>B.


科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是________,含有____________________________个水分子,含有________mol H。
(2)11.7 g NaCl的物质的量是________,含有____________个Na+,________________个
Cl-,共含离子________mol。
(3)3.01×1022个OH-的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________,这些OH-与________mol NH3的质量相同,和________g Na+含有的离子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 , 属于非电解质的有 .
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 .
(3)除去③中少量②的操作是 , 化学方程式为 .
(4)标准状况下,L④中含有0.4mol 氧原子.
(5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42﹣的物质的量浓度是 .
(6)若在⑦中缓慢加入⑥,产生的现象是 .
(7)将①加入到⑧中,⑧的导电能力变化为(填“增强”、“减弱”或“基本不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物检验方法正确的是( )
A. 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤素原子存在
B. 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙烯
C. 用溴水鉴别乙烯与乙炔
D. 用NaOH水溶液来鉴别一氯乙烷和三氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
(1)部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01molL﹣1)溶液的PH和原子序数的关系如图所示. 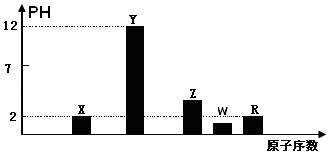
(i)元素R在周期表中的位置是
(ii)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(iii)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
(2)短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(i)下列能说明碳、硫两种元素非金属性相对强弱的是(填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(ii)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如图:
已知A是一种正盐,则反应I的化学反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验必须注意安全,下列说法中正确的组合是( )
①点燃氢气前要检验氢气的纯度,以免发生爆炸 ②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2 ③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子 ④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 ⑤稀释浓硫酸的操作如下图所示

A.①②③④ B.①②③ C.①②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质均能实现的是( )
A.Fe ![]() Fe2O3
Fe2O3 ![]() Fe2(SO4)3
Fe2(SO4)3
B.N2 ![]() NO2
NO2 ![]() HNO3
HNO3
C.S ![]() SO2
SO2 ![]() H2SO4
H2SO4
D.AgNO3(aq) ![]() Ag(NH3)2OH(aq)
Ag(NH3)2OH(aq) ![]() Ag
Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com