
关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3—对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3—还原为N2,其化学方程式为:10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O。
请回答下列问题:
①上述反应中_________元素的化合价升高,则该元素的原子____________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是_________________________________。
②漂白粉的有效成分是(填化学式)____________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___________________。
(1)① Al 失去
②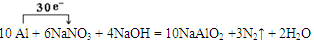
(2) ① 2 Ca(OH)2 + 2 Cl2 = CaCl2 + Ca(ClO)2 + 2 H2O ②Ca(ClO)2
③Ca2+ +2ClO- + CO2 + H2O = CaCO 3↓ + 2HClO
解析试题分析:(1)①在反应10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O中Al元素的化合价由反应前单质Al的0价变为反应后的NaAlO2中的+3价,化合价升高,该元素的原子失去电子,被氧化,作还原剂。②用单线桥法表示反应中电子转移的方向和数目为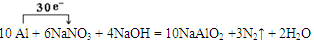
(2)①工业上将氯气通入石灰乳制取漂白粉,化学方程式是2 Ca(OH)2 + 2 Cl2 = CaCl2 + Ca(ClO)2 + 2 H2O. ②漂白粉的有效成分是Ca(ClO)2。③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,Ca(ClO)2+ CO2 + H2O = CaCO 3↓ + 2HClO离子方程式为Ca2+ +2ClO- + CO2 + H2O = CaCO 3↓ + 2HclO.
考点:考查氧化还原反应的表示、电子转移、化合价的升降、漂白粉的成分及漂白原理等知识。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:填空题
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________ (填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为78?65,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。
①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: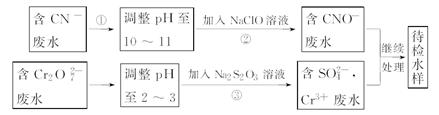
回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某体系中存在如下反应:
①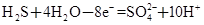 ②
②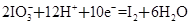
(1)反应①中H2S作_______剂,反应②属于_______反应。(填“氧化”或“还原”)
(2)若在反应①中失去0.2 mol电子,则反应②中可生成_______g碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:______。
(4)由上述反应可推知_______。
a.氧化性:K2SO4>KIO3 b.酸性:HIO3>H2SO4
c.还原性:H2S>I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
活性炭吸附法是工业提碘的主要方法之一。其流程如下: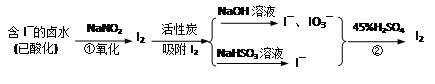
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3– + H2O H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
除去Al3+的离子方程式是 。
(3)为验证炉渣中含有FeO,先将炉渣用稀酸溶解,再在酸性条件下加入适当的氧化剂。(提供的试剂:稀盐酸、稀硫酸、KSCN溶液、酸性KMnO4溶液、NaOH溶液、碘水)
所选试剂为 、 ,证明炉渣中含有FeO的实验现象为 。
(4)配平上述反应的离子方程式(氧化性物质依据你的选择填入[ ])
Fe2++ H++ [ ] → Fe3++ [ ]+ H2O
(5)如果证明炉渣中是否含有FeO,将炉渣溶于稀硝酸,每含有1molFeO,可产生气体的体积是 L(标准状况,假设硝酸的还原产物只有NO)。
(6)Fe2O3可以作为染料,也可进一步制得净水剂Fe2(SO4)3, Fe2(SO4)3的净水原理是 (用相应的方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水(H2O)在很多化学反应中有极其重要的作用。请研究下列水参与的氧化还原反应。
①NaH+H2O=NaOH+H2↑ ②2Na2O2+2H2O=4NaOH+O2↑
③2Na+2H2O="2NaOH" +H2↑ ④3NO2+H2O=2HNO3+NO↑
⑤2H2O 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
(1)水只作氧化剂的是 ;水只作还原剂的是 ;水既作氧化剂,又作还原剂的是 ;水既不作氧化剂,又不是还原剂的是 。
(2)水作氧化剂时,被还原的元素是 ,水作还原剂时,被氧化的元素是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com