
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
(1)向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色。 (2分)
(2)①当最后一滴KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅红色且半分钟内不褪色。
(2分)
②0.04000 mol/L (3分,计算结果1分,有效数字1分,单位1分)
(3)【反应原理】 12、3、6 H2O;4、8 (3分,物质1分,配平2分)
【操作与现象】少量(3滴)硫酸(2分); 溶液颜色很快变成黄色,并出现棕黄色浑浊(2分)
【分析与结论】作空白对照实验(1分);
用煤油隔绝空气,并加入少量的铁屑和稀硫酸(2分)
解析试题分析:(1)久置的绿矾溶液容易被空气氧化变质,实质是其中的亚铁离子容易被氧化为铁离子,所以检验是否变质的方法是检验样品中是否含有铁离子,可选用KSCN试剂,操作是向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色。
(2)①使用紫红色的酸性高锰酸钾溶液滴定亚铁离子,所以到达终点时的现象是,最后一滴KMnO4溶液滴入锥形瓶中溶液颜色变成浅红色,且在半分钟内不褪色。
②实验中分了3次进行滴定,但是第2组数据消耗KMnO4溶液体积24.98ml明显高于其它2组,所以该数据应该舍去,所以消耗KMnO4溶液平均体积=(20.02mL+19.98mL)/2=20.00ml,所以根据方程式比例可得亚铁离子的浓度c(Fe2+)=5n(MnO4—)/V(Fe2+)="5×0.01000mol/L×20.00ml/25.00ml=0.04000" mol/L。计算中要注意有效数字的保留。
(3)【反应原理】此处考察的是氧化还原反应的缺项配平,根据产物Fe(OH)3 中含有H,可以推测原反应物必有水参加,所以缺项处为H2O;再根据氧化还原的特点找出化合价变化的Fe和O,用得失电子守恒来进行配平,可得到方程式为12Fe2+ +3O2 +6 H2O = 4Fe(OH)3↓+ 8Fe3+ 。
【操作与现象】由图中所给的四个试管和添加试剂可以看出,这四组实验目的是在比较在不同条件下FeSO4溶液的保存效果。所以领会题目意图,要充分应用上一题的反应方程式12Fe2+ +3O2 +6 H2O = 4Fe(OH)3↓+ 8Fe3+来解题。试管①对硫酸亚铁溶液没有做任何处理,试管①自然会发生反应式中的现象,亚铁离子很快被氧化为棕黄色的铁离子,同时还会有Fe(OH)3 沉淀产生。鉴于试管①,试管②添加了一层煤油以使溶液隔绝氧气,此方法必然会减缓亚铁离子被氧化;试管③添加了铁粉,铁粉可以把铁离子还原为亚铁离子,起到防氧化的目的,氧化减慢;考虑到亚铁离子除了被氧化之外,还容易发生水解,所以试管④中应该添加几滴稀硫酸溶液。
【分析与结论】所以综上所述,试管①设计意图只是用于作空白对照实验,而保存FeSO4溶液最佳方案应该是综合②③④操作,用煤油隔绝空气,并加入少量的铁屑和稀硫酸。
考点:本题考查的是综合探究实验,涉及的主要是铁盐的内容,围绕铁这块知识作答。


科目:高中化学 来源: 题型:填空题
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 | 平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ | 7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ | 3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ | 3.2 × 10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是 。
(2)用MnO2制KMnO4的工艺流程如图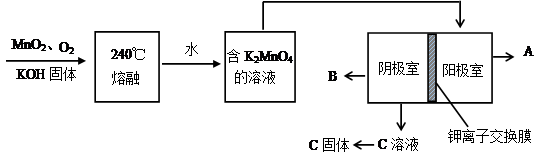
电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (写化学式,下同),可以循环使用的物质是 。
④钾离子交换膜的一种材料是聚丙烯酸钾(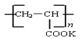 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是 (精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应氧化产物的物质的量分别是________________。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82—+2I-=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:______________________________、____________________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组用以下装置探究SO2的某些化学性质。
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式: Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
________KBrO3+________+________H2SO4―→……;
③若转移10 mol电子,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3—对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3—还原为N2,其化学方程式为:10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O。
请回答下列问题:
①上述反应中_________元素的化合价升高,则该元素的原子____________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是_________________________________。
②漂白粉的有效成分是(填化学式)____________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com