
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应氧化产物的物质的量分别是________________。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82—+2I-=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:______________________________、____________________________(不必配平)。
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 ,反应中消耗1mol的MnO4—时转移电子数为 。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)氧化剂是 , 元素被氧化;
(2)用“双线桥”表示该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ;
II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平):
2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU 芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材 料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2 +I2
+I2 S4
S4 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| | 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
 Ce(OH)4↓+ 。
Ce(OH)4↓+ 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: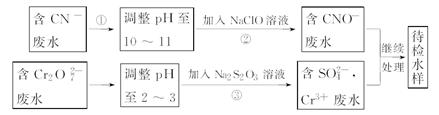
回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是________________。
(3)把KI换成KBr,则CCl4层变成________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为25.4mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
活性炭吸附法是工业提碘的主要方法之一。其流程如下: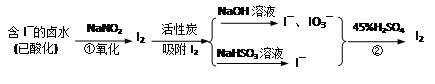
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3– + H2O H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; | C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com