
MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是 。
(2)用MnO2制KMnO4的工艺流程如图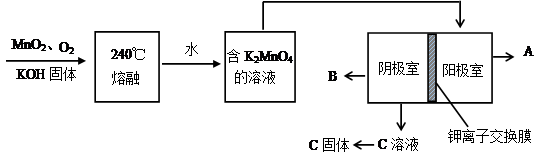
电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (写化学式,下同),可以循环使用的物质是 。
④钾离子交换膜的一种材料是聚丙烯酸钾(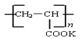 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是 (精确到0.1%)。
(1)MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O
(2)①2MnO2 + O2 + 4KOH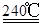 2K2MnO4 + 2H2O ,大于(或 >)2 : 1
2K2MnO4 + 2H2O ,大于(或 >)2 : 1
② MnO42- - e- = MnO4- ③ H2,KOH固体 ④ CH2="CHCOOK" ⑤ 95.8%
解析试题分析:(1)根据题意,结合电荷守恒、原子守恒、电子守恒,可得方程式为:MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O。(2)①在240℃熔融时MnO2、O2、KOH发生氧化还原反应,根据质量守恒定律和电子守恒的知识可知发生该反应的化学方程式为:2MnO2 + O2 + 4KOH 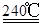 2K2MnO4 + 2H2O。由方程式可知在投料时必须满足n(KOH):n(MnO2)=2:1,为了使MnO2充分发生反应,KOH必须过量。因此二者的物质的量的比要大于2:1. ②由题意知道K2MnO4应该在阳极发生氧化反应,失去电子,被氧化为KMnO4。所以阳极的电极反应为MnO42- - e- = MnO4- 。③在阴极发生反应:2H2O+2e-=H2↑+2OH-.所以B物质是H2。根据电极反应式可以看出在此过程中可以循环的物质为KOH。④钾离子交换膜的一种材料是聚丙烯酸钾 。该物质为丙烯酸钾发生加聚反应得到的,其结构简式为 CH2=CHCOOK。⑤Na2C2O4与酸性KMnO4溶液发生反应的方程式为:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)="0.335" g÷134g/mol=0.0025mol;则根据反应方程式可知消耗的KMnO4的物质的量为0.0025mol×2/5=0.001mol.其质量为0.001mol×158g/mol=0.158g.所以该KMnO4的纯度是0.158g÷0.165 g×100%=95.8%.
2K2MnO4 + 2H2O。由方程式可知在投料时必须满足n(KOH):n(MnO2)=2:1,为了使MnO2充分发生反应,KOH必须过量。因此二者的物质的量的比要大于2:1. ②由题意知道K2MnO4应该在阳极发生氧化反应,失去电子,被氧化为KMnO4。所以阳极的电极反应为MnO42- - e- = MnO4- 。③在阴极发生反应:2H2O+2e-=H2↑+2OH-.所以B物质是H2。根据电极反应式可以看出在此过程中可以循环的物质为KOH。④钾离子交换膜的一种材料是聚丙烯酸钾 。该物质为丙烯酸钾发生加聚反应得到的,其结构简式为 CH2=CHCOOK。⑤Na2C2O4与酸性KMnO4溶液发生反应的方程式为:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)="0.335" g÷134g/mol=0.0025mol;则根据反应方程式可知消耗的KMnO4的物质的量为0.0025mol×2/5=0.001mol.其质量为0.001mol×158g/mol=0.158g.所以该KMnO4的纯度是0.158g÷0.165 g×100%=95.8%.
考点:考查化学方程式、离子方程式的书写、电解池的化学反应原理、聚合物与单体的相互转化、物质的转化率的计算的知识。


科目:高中化学 来源: 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+ +H2SO4—→ + + + +H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则①Br2的化学计量数是 ;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
KBrO3+ + H2SO4—→……;
③若转移10 mol电子,则反应后生成I2的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________ (填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为78?65,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。
①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)氧化剂是 , 元素被氧化;
(2)用“双线桥”表示该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ;
II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平):
2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU 芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材 料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2 +I2
+I2 S4
S4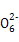 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| | 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
 Ce(OH)4↓+ 。
Ce(OH)4↓+ 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: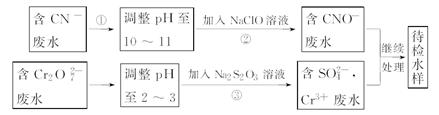
回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
除去Al3+的离子方程式是 。
(3)为验证炉渣中含有FeO,先将炉渣用稀酸溶解,再在酸性条件下加入适当的氧化剂。(提供的试剂:稀盐酸、稀硫酸、KSCN溶液、酸性KMnO4溶液、NaOH溶液、碘水)
所选试剂为 、 ,证明炉渣中含有FeO的实验现象为 。
(4)配平上述反应的离子方程式(氧化性物质依据你的选择填入[ ])
Fe2++ H++ [ ] → Fe3++ [ ]+ H2O
(5)如果证明炉渣中是否含有FeO,将炉渣溶于稀硝酸,每含有1molFeO,可产生气体的体积是 L(标准状况,假设硝酸的还原产物只有NO)。
(6)Fe2O3可以作为染料,也可进一步制得净水剂Fe2(SO4)3, Fe2(SO4)3的净水原理是 (用相应的方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com