
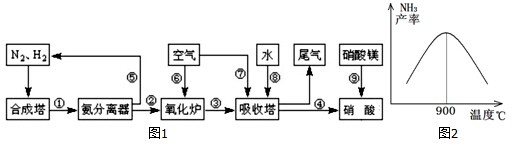
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
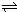 CO2 +H2
CO2 +H2| 0.12×0.12 |
| 0.08×0.18 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| A、1.25V L |
| B、2.25V L |
| C、2.5V L |
| D、3.5V L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使酸性高锰酸钾溶液褪色 |
| B、能水解 |
| C、能使溴的四氧化碳溶液褪色 |
| D、能与Na2CO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混和液中c(Cl-)=c(Na+) |
| B、混和液中c(Cl-)=2c(SO42-) |
| C、混和前两溶液体积相等 |
| D、混和前两溶液中MgCl2与Na2SO4物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
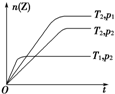 反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2 |
| B、T1<T2,p1>p2 |
| C、T1>T2,p1>p2 |
| D、T1>T2,p1<p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
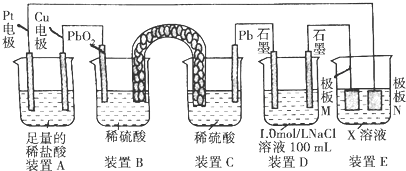
 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| B、分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
| C、加热氯化钠溶液得氯化钠固体,需用表面皿 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、计算需要Na2CO3.10 H2O的质量为28.0 g |
| B、用带游码的托盘天平称量时误用了“左码右物”方法,而导致所配溶液浓度偏低 |
| C、定容时,沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液的凹液面的最低处恰好与刻度线相切为止即可 |
| D、定容时,不慎加蒸馏水超过刻度线,在超量不多的情况下可以立即用胶头滴管将多余的水吸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com