
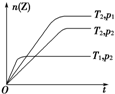
 反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2 |
| B、T1<T2,p1>p2 |
| C、T1>T2,p1>p2 |
| D、T1>T2,p1<p2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、所得130mL剩余气体中是CO、CO2的混合物 |
| B、所得130mL剩余气体的平均相对分子质量是30 |
| C、60mL混合气体含甲烷为20mL |
| D、根据题给条件无法求出60mL混合气体中甲烷或乙烷的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44n | B、18n |
| C、14n | D、0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、1.0 mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO
| ||
C、1.0 mol?L-1的FeCl2溶液:NO
| ||
D、澄清透明的溶液:Cu2+、SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极:蓝,阴极:红 |
| B、阳极:白,阴极:蓝 |
| C、阳极:红,阴极:蓝 |
| D、阳极:蓝,阴极:蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3mol |
| B、0.05mol |
| C、0.2mol |
| D、0.1mo |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com