
| A、0.3mol |
| B、0.05mol |
| C、0.2mol |
| D、0.1mo |


科目:高中化学 来源: 题型:
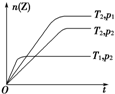 反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2 |
| B、T1<T2,p1>p2 |
| C、T1>T2,p1>p2 |
| D、T1>T2,p1<p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | ||
B、pH=4的NH4Cl溶液,溶液中c (H+)>c (OH-),且
| ||
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) | ||
| D、冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2密度的45倍. | 试通过计算填空: (1)A的摩尔质量为: |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如图: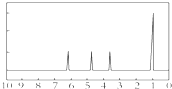 | (4)A中含有 |
| (5)综上所述,A的结构简式 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱溶液去油污 |
| B、铁在潮湿的环境下生锈 |
| C、向氯化铁溶液中滴入氢氧化钠溶液产生红褐色沉淀 |
| D、浓硫化钠溶液有臭味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、计算需要Na2CO3.10 H2O的质量为28.0 g |
| B、用带游码的托盘天平称量时误用了“左码右物”方法,而导致所配溶液浓度偏低 |
| C、定容时,沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液的凹液面的最低处恰好与刻度线相切为止即可 |
| D、定容时,不慎加蒸馏水超过刻度线,在超量不多的情况下可以立即用胶头滴管将多余的水吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“1,4-二氧杂环乙烷”与丁酸互为同分异构体 |
| B、甲醛在常温下是一种无色易挥发的液体 |
| C、“1,4-二氧杂环乙烷”可以与钠反应放出H2 |
| D、四步反应的条件可以依次为:浓H2SO4、溴水、NaOH醇溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com