

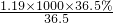 =11.9mol,故该盐酸的浓度是11.9mol/L,故答案为:11.9;
=11.9mol,故该盐酸的浓度是11.9mol/L,故答案为:11.9;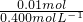 =0.025L=25mL,故答案为:25;
=0.025L=25mL,故答案为:25; 判断;
判断; 判断,分析变化的物理量,从而确定浓度的变化,本题难度中等.
判断,分析变化的物理量,从而确定浓度的变化,本题难度中等. 

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:阅读理解
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
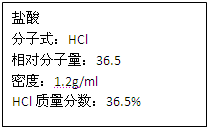 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com