
【题目】对于下列反应的说法中正确的是( )
A. 2CuFeS2+O2===Cu2S+2FeS+SO2,CuFeS2是氧化剂,O2是还原剂
B. 3NO2+H2O===2HNO3+NO,氧化产物与还原产物的物质的量之比为2∶1
C. 反应KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,生成3molCl2,转移电子6mol
D. Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
+6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
【答案】B
【解析】A.2CuFeS2中Cu元素化合价为+2价,Fe为+2价,S为-2价,反应中Cu元素化合价由+2价降低到+1价,S元素化合价由-2价升高到+4价,则CuFeS2既是氧化剂又是还原剂,故A错误;B.3NO2+H2O═2HNO3+NO,氧化产物为2HNO3,还原产物为NO,由方程式可知氧化产物与还原产物的物质的量之比为2:1,故B正确;C.反应KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,生成3molCl2,转移电子5mol,故C错误;D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,还原性Cr3+<Fe2+,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】某混合物浆液含少量Na2CrO4,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。已知:阴极池中得到NaOH和H2,阳极池中得到含有Cr2O72-和CrO42-的混合溶液。

(1)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是____________________。
(2)离子交换膜I属于________________(填“阳膜”或“阴膜”),阳极的电极反应方程式为___。生成Cr2O72-的原因____________(离子反应方程式和必要的文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在马铃薯幼苗的培养液中,除了必需的微量元素、NH+4、PO43-和CO2外,还必需的大量元素是( )
A.C、H、O、N、P、MnB.K、Ca、Mg、S
C.Mn、Mo、Cu、ZnD.K、Ca、Mg、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A至F都是化合物,且A、B、E、F均含钠元素,G为单质,是空气的主要成分之一。
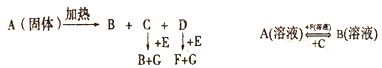
(1)钠离子的结构示意图为__________。含钠元素的物质焰色反应时呈___________。
(2)写出A、B、E、F的化学式:A______;B_______;E______;F______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是( )
A. CuO+2HNO3=Cu(NO3)2+H2O B. C+4HNO3(浓)= CO2+2H2O+4NO2↑
C. Cu+4HNO3(浓)![]() Cu(NO3)2+2H2O+2NO2↑ D. NH3+HNO3=NH4NO3
Cu(NO3)2+2H2O+2NO2↑ D. NH3+HNO3=NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将23gNa、18gAl、56gFe分别投入盛有200g 7.3%的盐酸中(气体体积均在相同状况下测定),下列分析正确的是( )
A. 产生的气体体积之比为5:2:2
B. Al和盐酸的反应速率仅次于钠,但产生的气体最多
C. 铁和盐酸反应产生的气体比Na产生的多
D. Na和盐酸反应最剧烈,反应结束时产生的气体一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学反应的离子方程式正确的是
A. 二氧化锰和浓盐酸共热: MnO2 +4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加过量的浓氨水:Al3++4NH3·H2O=AlO![]() +4NH4++2H2O
+4NH4++2H2O
C. 将Cu2O与稀HNO3混合:3Cu2O+14H++2NO![]() ===6Cu2++2NO↑+7H2O
===6Cu2++2NO↑+7H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
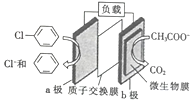
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com