
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是_________。
(2)C装置中浓硫酸的作用是__________。
(3)D装置中MnO2的作用是___________。
(4)燃烧管中CuO的作用是_________。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为________。
(6)要确定该物质的分子式,还要知道该物质的______,经测定其蒸气密度为2.054 g/L(已换算为标准状况下),则其分子式为____________。
【答案】 g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 吸收H2O,得到干燥O2 催化剂,加快O2的生成 使有机物充分氧化生成CO2和H2O C2H6O 相对分子质量 C2H6O
【解析】(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选择装置各导管的连接顺序是g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果;(3)MnO2为分解制备氧气的催化剂;(4)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;(5)A管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:1.76g×12/44=0.48g;B管质量增加1.08g说明生成了1.08g水,可得氢元素的质量:1.08g×2/18=0.12g,从而可推出含氧元素的质量为:0.92g-0.48g-0.12g=0.32g,设最简式为CXHYOZ,X:Y:Z=0.48/12:0.12:0.32/16,解得X:Y:Z=2:6:1,即最简式为C2H6O;(6)在已知最简式的情况下,要确定该化合物的化学式,则还需要测出有机物的相对分子质量。经测定其蒸气密度为2.054g/L(已换算为标准状况下),则其相对分子质量是2.054×22.4=46,因此其分子式为C2H6O。


科目:高中化学 来源: 题型:
【题目】有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 | B | C | D | E | F |
原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
(1)D在元素周期表中的位置______________;E的离子结构示意图______________。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由________________________________。
(3)用电子式表示B的单质与D的单质形成化合物的过程________________________。
(4)下列各项比较,正确的是________________________。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因______________________________________________________________。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式________________。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为________________________________。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式___________________________。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一) A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
![]()
(1)若A、B、C、D均为化合物,而且它们的水溶液均能使湿润的蓝色石蕊试纸变红,则D的化学式为________,写出B→C的化学反应方程式:____________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为__________________。写出A→B的化学反应方程式:_______。
(3)若A为单质,组成元素的原子所含质子的数目小于18,D为强碱,则B的化学式:________________。
(二)(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为______________ 。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图是实验室制取和收集气体的常用装置:
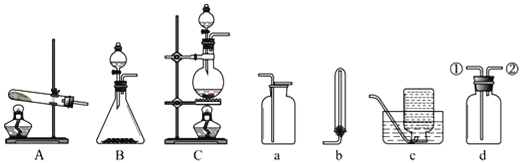
(1)用A装置制取氨气的化学方程式是___________________________________。若用B装置制取氨气,则选用的药品是________________________________。
(2)收集干燥氨气时,选用的干燥剂是___________________________________。
(3)图a、b、c、d是某学生设计的收集气体的几种装置.若用d装置收集氨气,则气体流向为___________(用序号说明).若要收集NO气体,则应选择______装置;
(4)若用C装置与d装置相连制取并收集X气体,则X可能是下列气体中的_____。
①CO2 ②NO ③Cl2 ④SO2 ⑤NH3
(5)按图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是_______________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________________________________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式________,已知该反应在较低温条件下能自发进行,则该反应的△H ____0(填“>”“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. CO 的质量不再变化 b. 混合气体的密度不再变化
c.单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化
②10min 内该反应的速率 ν(NO)=____________;该温度下化学平衡常数 K=_________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
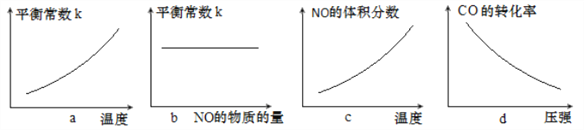
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,有以下三种物质:①18 g H2O;②11.2 L H2S气体;③0.5 mol C2H5OH(酒精)。下列排列顺序正确的是
A. 密度:①>③>② B. 体积:①>③>②
C. 质量:③>②>① D. 氢原子数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.
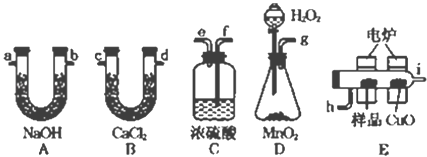
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→ → →h→i→ → → → ._______________
(2)燃烧管中CuO的作用是______.
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取3.24g样品,经充分反应后,A管质量增加9.24g,B管质量增加2.16g,则该样品的实验式为______.
(4)要确定该物质的分子式,还要知道该物质的______.经测定其蒸气密度为4.82g/L(已换算为标准状况下),则其分子式为______.
(5)经红外光谱分析知该化合物的分子中存在1个苯环,苯环上只有1个支链,且支链中有1个甲基.试写出该有机物的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A. 有CO、CO2、O3三种气体,它们各含有1 mol O,则三种气体物质的量之比为3:2:1
B. n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C. 常温下,a L氧气和氮气的混合物含有的分子数就是(a/22.4)×6.02×1023个
D. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com