
【题目】有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 | B | C | D | E | F |
原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
(1)D在元素周期表中的位置______________;E的离子结构示意图______________。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由________________________________。
(3)用电子式表示B的单质与D的单质形成化合物的过程________________________。
(4)下列各项比较,正确的是________________________。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因______________________________________________________________。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式________________。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为________________________________。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式___________________________。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论________________________________。
【答案】 第三周期,第ⅥA族 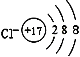 氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构)
氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构) ![]() ① Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒 2Al+2OH-+2H2O=2AlO2- +3H2↑ 2Al+Fe2O3
① Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒 2Al+2OH-+2H2O=2AlO2- +3H2↑ 2Al+Fe2O3![]() Al2O3+2Fe Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol NH3 + H3O+=NH4+ + H2O
Al2O3+2Fe Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol NH3 + H3O+=NH4+ + H2O
【解析】已知A的单质是最清洁的能源物质,A是H;根据元素的原子半径及主要化合价可知D一定是S,E一定是Cl,F一定是O,则B一定是Na,C一定是Al。
(1)S在元素周期表中的位置是第三周期第ⅥA族;Cl-离子结构示意图为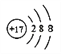 。(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为
。(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为![]() 。(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3
。(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。(9)根据反应NH3+H3O+=NH4++H2O可说明NH3结合质子的能力强于水。
Al2O3+2Fe。(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。(9)根据反应NH3+H3O+=NH4++H2O可说明NH3结合质子的能力强于水。


科目:高中化学 来源: 题型:
【题目】Ⅰ. 写出下列反应的化学方程式:
(1)丙烯制备聚丙烯:_______________________________________________________;
(2)甲苯与Cl2光照反应生成一氯代物:_______________________________________;
(3)制备硝基苯:___________________________________________________________;
(4)2-甲基-1,3-丁二烯与Br2的1,4-加成反应____________________________;
Ⅱ.核磁共振氢谱是研究有机物结构的有力手段之一。现有某种有机物,通过元素分析得到的数据为C∶85.71%,H∶14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的分子式为____________。
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A是链状化合物与氢气加成产物分子中有三个甲基,则A的可能结构有________种(不考虑立体异构)。
②B是链状化合物,1H—NMR谱中只有一个信号,则B的结构简式为______________。
③C是环状化合物,1H—NMR谱中也只有一个信号,则C的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为-285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ/mol
B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g) H2O(l) △H= -445 kJ/mol
CO2(g) H2O(l) △H= -445 kJ/mol
C. 已知C(石墨,s)![]() C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ/mol
2NH3(g) ΔH=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图的分析中,不正确的是( )

A. 如果该图为组成活细胞中的元素,则A是氧元素
B. 如果该图表示的菠菜叶肉细胞中的元素,则其中Mo的含量很少
C. 如果该图表示的是组成骨骼肌细胞的化合物,则A是蛋白质
D. 如果该图为组成大豆细胞的有机物,则A肯定含有的元素是C、H、0、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X 是某种药物的主要成分,工业上合成该化合物的一种路线如下(部分反应物、反应条件略去):

已知:酯与含羟基的化合物可发生如下酯交换反应:![]() (其中R、
(其中R、![]() 、
、![]() 均代表烃基)
均代表烃基)
(1)反应①所需反应条件是_______________,反应②的反应类型是________________。
(2)E中官能团的名称是_____________; 反应④的产物除了X以外。另一种产物的名称是_________。
(3)D在一定条件下能发生缩聚反应生成高分子化合物,该高分子化合物的结构简式为_____________。
(4)反应③的化学方程式为_____________________________。
(5)D的同分异构体有多种,写出符合下列条件的有机物结构简式____________。
Ⅰ.苯环上一氯代物只有一种
Ⅱ.与氯化铁溶液发生显色反应
Ⅲ.能与新制Cu(OH)2悬浊液共热产生红色沉淀
Ⅳ.1mol该物质与足量的钠充分反应产生标准状况下22.4LH2
(6)已知:
①![]() ;
;
②当苯环上已有一个“-CH3”或“-Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“-NO2”或“-COOH”时,新引入的取代基一般在它的间位。
请写出以甲苯、乙醇为原料制备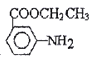 的合成路线图(无机试剂任用)___________。
的合成路线图(无机试剂任用)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某反应的微观示意图,下列有关说法不正确的是

A. 生成的物质都是氧化物
B. 反应前后原子的种类不变
C. 该反应的基本类型属于置换反应
D. 反应方程式为2H2S+3O2 ![]() 2SO2+2H2O
2SO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中,可大量共存的离子组是
A.Cu2+、NO3-、Cl-、SO42-B.H+、Cl-、K+、CO32-
C.Na+、HCO3-、SO42-、Cl-D.K+、Mg2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_____、_______、________。
(2)下列分子中若有手性原子,请用“*”标出其手性碳原子。____________
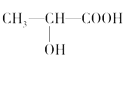
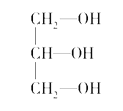
(3)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填序号)________________。
(4)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):HClO3________HClO4;
(5)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的立体构型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是_________。
(2)C装置中浓硫酸的作用是__________。
(3)D装置中MnO2的作用是___________。
(4)燃烧管中CuO的作用是_________。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为________。
(6)要确定该物质的分子式,还要知道该物质的______,经测定其蒸气密度为2.054 g/L(已换算为标准状况下),则其分子式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com