
����Ŀ����. д�����з�Ӧ�Ļ�ѧ����ʽ��
��1����ϩ�Ʊ��۱�ϩ��_______________________________________________________��
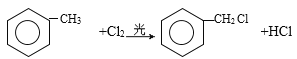
��2���ױ���Cl2���շ�Ӧ����һ�ȴ��_______________________________________��
��3���Ʊ���������___________________________________________________________��
��4��2������1��3������ϩ��Br2��1��4���ӳɷ�Ӧ____________________________��
��.�˴Ź����������о��л���ṹ�������ֶ�֮һ������ij���л��ͨ��Ԫ�ط����õ�������ΪC��85.71%��H��14.29%(��������)���������ݱ���������Է�������Ϊ84��
��1���û�����ķ���ʽΪ____________��
��2����֪�����ʿ��ܴ��ڶ��ֽṹ��A��B��C�����е����֣����������Ҫ����գ�
��A����״�������������ӳɲ��������������������A�Ŀ��ܽṹ��________��(�����������칹)��
��B����״�����1H��NMR����ֻ��һ���źţ���B�Ľṹ��ʽΪ______________��
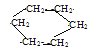
��C�ǻ�״�����1H��NMR����Ҳֻ��һ���źţ���C�Ľṹ��ʽΪ______________��
���𰸡� ![]()

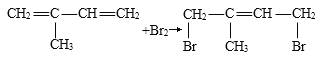 C6H12 7
C6H12 7 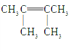
����������. ��1����ϩ�Ʊ��۱�ϩ�� ��
��
��2���ױ���Cl2���շ�Ӧ����һ�ȴ�� CH3-C6H5+Cl2=Cl-CH2-C6H5+HCl��
��3���Ʊ���������![]() ��
��
��4��2������1��3������ϩ��Br2��1��4���ӳɷ�ӦCH2=C��CH3��--CH=CH2+Br2![]() BrCH2C��CH3��=CHCH2Br ��
BrCH2C��CH3��=CHCH2Br ��
��.��C��85.71%��H��14.29%(��������)���������ݱ���������Է�������Ϊ84��
��1��Cԭ��Ϊ����84![]() ��/12=6 Hԭ��Ϊ (84
��/12=6 Hԭ��Ϊ (84![]() 14.29%)/2=12���û�����ķ���ʽΪC6H12��
14.29%)/2=12���û�����ķ���ʽΪC6H12��
��2����֪�����ʿ��ܴ��ڶ��ֽṹ��A��B��C�����е����֣����������Ҫ����գ�
��A�ķ���ʽ��C6H12������״�������������ӳɲ��������������������AΪ����һ��֧���ĵ�ϩ����A�Ŀ��ܽṹ��![]() �Ƽ���3�֣���˫����2�֣�
�Ƽ���3�֣���˫����2�֣�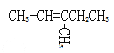 ��˫����2�֣�����7��ͬ���칹����
��˫����2�֣�����7��ͬ���칹����
��B����ʽC6H12������״�����1H��NMR����ֻ��һ���ź�˵���ṹʽ��ֻ��һ����������BΪ��ȫ�Գ�ʽ�ĵ�ϩ������B�Ľṹ��ʽΪ![]() ��
��
��C����ʽC6H12�ǻ�״�����1H��NMR����Ҳֻ��һ���źţ�����ֻ��һ�������Ͷȣ�����CΪ�����飬��C�Ľṹ��ʽΪ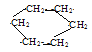 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ�����Ͻ��ܼ��ŵ���(����)
A. ���ݶ���װ̫������ˮ��Ϊ�����ṩ��������ˮ
B. ������չ�������������������������
C. ��ʯ�Ҷ�úȼ�պ��γɵ�����������������ʯ��
D. ���Ӳݡ������������л����������������з��Ͳ�������������ͥȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��F2(g) === 2HF(g) ��H����270kJ/mol������˵����ȷ���ǣ� ��
A. 1������������1���������ӷ�Ӧ����2����������ӷų�270kJ
B. 1mol������1mol������Ӧ����2molҺ̬������ų�������С��270kJ
C. ����ͬ�����£�1mol������1mol�����������ܺʹ���2mol���������������
D. 2mol����������ֽ��1mol��������1mol�ķ����ų�270kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�ҷ��֣���ͨ��ˮ�����ߵ粨�������¿�ȼ�ա���һΰ��ķ��֣������������ˮ��������Դ���ش����⡣���ߵ�Ƶ�ʿ��Խ�����ˮ������Ԫ��֮���������������ͷų���ԭ�ӣ��������ԭ�Ӿͻ��ڸ�Ƶ���³���ȼ�ա������е����������ʵ����( )
A.���ۼ�B.���C.���Ӽ�������D.���Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ���ʵ�˵����ȷ����
A. �����¶ȣ����Լӿ췴Ӧ���ʣ����̿��淴Ӧ�ﵽƽ���ʱ��
B. ��ѧ��Ӧ�ﵽ�����ʱ�����淴Ӧ����Ҳ�ﵽ��������
C. ���ӹ��巴Ӧ��������Լӿ췴Ӧ����
D. ����Ƭ��ϡ���ᷴӦ��H2���õ�Ũ�������H2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У���Ҫ�������������ǣ� ��
A.2Cl����Cl2
B.Fe3+��Fe2+
C.Cu2+��Cu
D.MnO4����MnO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ᾭ�õķ�չ����������ˮƽ����ߺͶԻ���Ҫ��ļ�ǿ����Դ�㷺�ĸ߰�����ˮ(��Ҫ����NH4+)����Խ��Խ�ܵ����ӡ����ڸ߰�����ˮ�Ĵ����ж��ַ�����
��1�����ѷ�:
![]()
ʹ�ô��ѷ�ʱ��Ҫ�ڢ��м���д�����������ӷ�Ӧ����ʽ______________________��
��2��MAP��������
��ʹ�û�ѧ�����������߰�����ˮʱ����߰�����ˮ��Ͷ�뺬��Mg2+�����ʺ�H3PO4��������ҺpH����NH4+��Ӧ����MgNH4PO4(MAP)������Ϊ��Ч������ҺPH����������ˮ����Ч���������ѡ������������_____��
A MgO B MgSO4 C MgCl2
��������ҺPH�ĺ�����ΧΪ____________________
�����ܽ�ƽ��ǶȽ���PH������Ͳ����γɳ���MAP��ԭ����֪PO43-�����Խ�ǿ��������HPO42-��ʽ���ڣ�_______________
��3�������ѵ���ͳ���գ�
�����������������£������ں��������Ҫ�Ǻ�����������������NO3-��д����Ӧ�����ӷ���ʽ_________________________��
�������������������£����������������������������ʹNO3-��״���������N2���ﵽ����ˮ��Ŀ�ġ�д�����ӷ���ʽ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ú��ʯ�ͺ���Ȼ�����ۺ����ã�����˵����ȷ����
A.ˮú����Ҫ�ɷ���CH4
B.ú��������Һ����ʯ�͵ķ����������仯
C.�ѽ��Ŀ����������͵IJ���������
D.����ֱ�����ͺ��ѻ����ͣ�������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ�����Ԫ�أ���֪A�ĵ�������������Դ���ʣ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ����±���
Ԫ�ش��� | B | C | D | E | F |
ԭ�Ӱ뾶/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +1 | +3 | +6��-2 | +7��-1 | -2 |
����������Ϣ�ش��������⡣
��1��D��Ԫ�����ڱ��е�λ��______________��E�����ӽṹʾ��ͼ______________��
��2������AԪ�������ڱ��е�λ�ã�һֱ���ڷ������������Ű������ڵ���A�壬�Է���������________________________________��
��3���õ���ʽ��ʾB�ĵ�����D�ĵ����γɻ�����Ĺ���________________________��
��4�����и���Ƚϣ���ȷ����________________________��
���⻯��ķе㣺D����F ��A~FԪ�صļ����Ӱ뾶��C�����
����̬�⻯���ȶ��ԣ�D��E�ȶ� ������������Ӧ��ˮ������ԣ�BС��C
��5��E���ʳ���������ˮ�������ñ�Ҫ�����ֺ����ӷ���ʽ����ԭ��______________________________________________________________��
��6��д��C�ĵ�����B������������ˮ���ﷴӦ�����ӷ���ʽ________________��
��7��C�ĵ�����Ԫ��M�ĺ���ɫ������N��Ӧ�����ں��Ӹֹ죬�÷�Ӧ�Ļ�ѧ����ʽΪ________________________________��
��8����֪����M��ȼ����Ϊ375kJ/mol��д����ʾ��ȼ���ȵ��Ȼ�ѧ����ʽ___________________________��
��9����֪NH3������ӵ�����ǿ��F���⻯�������ǡ�������ӷ���ʽ֤���������________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com