
【题目】已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( )
A. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含贫抗疟疾的物质——青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。

下列说法错误的是
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. ①、②的反应类型分別为还原反应、取代反应
C. 可用质谱法确定分子中含有何种官能团的信息
D. 双氢青蒿素在水中的溶解性大于青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”);盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大、偏小、无影响”);在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=_______。根据计算结果,写出该中和反应的热化学方程式______________________。
(5)实验中改用60 mL 1.0 mol·L-1的盐酸跟50 mL 1.1mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________ (填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)VO43-的中心原子价层孤电子对数目为______,一个VO43-离子中含有_______个σ键;
(3)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
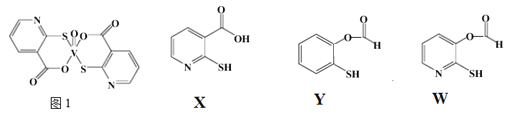
①该药物中N原子的杂化方式是_______;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]()
![]() 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]()
![]() 。
。
③下列微粒中存在“离域Π键”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π键可以表示为_______________;
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(5)某六方硫钒化合物晶体的晶胞如图4所示(![]() 表示V,
表示V,![]() 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
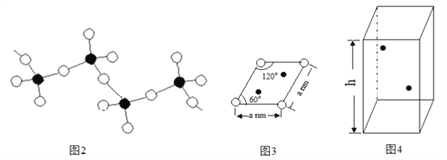
①请在图4中用![]() 标出V原子的位置;
标出V原子的位置;
②已知晶胞的密度为dg/cm3 ,计算晶胞参数h =_____________cm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草药中有一种色素A,它的结构简式为![]() ,用它制成的试剂以检验物质的
,用它制成的试剂以检验物质的
酸碱性。能够跟1molA起反应的Br2(水溶液)或H2的最大用量分别是 ( )
A. 3 mol、5 mol B. 6 mol、8 mol C. 10 mol、8 mol D. 6 mol、10 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.SO2 和 Na2SO3 溶液都能使氯水褪色D.常温下铁和铂都不溶于浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成路线如图所示。
![]()
(1)已知AlCl3的熔点为190℃,沸点为178℃,在湖湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3。

①写出圆底烧瓶中发生反应的离子方程式:_________________。
②按气流方向连接各仪器接口,顺序为a→__________b→c→_______。 (填接口字母)
③装置F中应盛装的试剂是__________,装置D的作用是______________。
(2)AlCl3与NaH反应时,需先将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是______________。
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化的与水反应的化学方程式为______________。
②设计如下四种装置测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是___(填编号)。

③某同学选用上述最恰当的裴置,称取mg铝氢化钠样品,测得生成气体的体积为VL(已折算为标准状况),重复实验操作三次,测得有关数据如下表所示,则样品中铝氢化钠的纯度为____。
实验次数 | 样品质量m(g) | 气体休积V(L) |
I | 1.20 | 1.907 |
II | 1.20 | 1.904 |
III | 1.20 | 1,901 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 写出下列反应的化学方程式:
(1)丙烯制备聚丙烯:_______________________________________________________;
(2)甲苯与Cl2光照反应生成一氯代物:_______________________________________;
(3)制备硝基苯:___________________________________________________________;
(4)2-甲基-1,3-丁二烯与Br2的1,4-加成反应____________________________;
Ⅱ.核磁共振氢谱是研究有机物结构的有力手段之一。现有某种有机物,通过元素分析得到的数据为C∶85.71%,H∶14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的分子式为____________。
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A是链状化合物与氢气加成产物分子中有三个甲基,则A的可能结构有________种(不考虑立体异构)。
②B是链状化合物,1H—NMR谱中只有一个信号,则B的结构简式为______________。
③C是环状化合物,1H—NMR谱中也只有一个信号,则C的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为-285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ/mol
B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g) H2O(l) △H= -445 kJ/mol
CO2(g) H2O(l) △H= -445 kJ/mol
C. 已知C(石墨,s)![]() C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ/mol
2NH3(g) ΔH=-38.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com