
科目:高中化学 来源: 题型:
(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
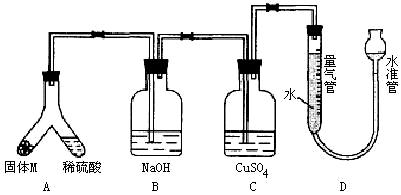
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式)
理由是_____________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
(B)
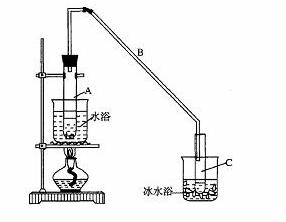
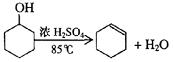
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热
至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
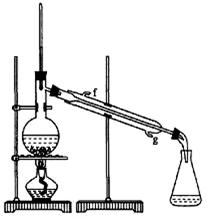
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
| 步骤2:
| 结合步骤1的现象和结论,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量Q kJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2 + 2NaOH = Na2CO3 + H2O,共消耗了4mol·L-1的NaOH溶液200 mL。则此条件下,下列热化学方程式正确的是 ( )
A.C4H10(g)+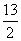 O2(g)===4CO2(g)+5H2O(l) ΔH=-Q kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-Q kJ·mol-1
B.C4H10(g)+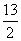 O2(g)===4CO2(g)+5H2O(l) ΔH=-10Q kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-10Q kJ·mol-1
C.C4H10(g)+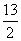 O2(g)===4CO2(g)+5H2O(l) ΔH=+ 10Q kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=+ 10Q kJ·mol-1
D.C4H10(g)+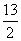 O2(g)===4CO2(g)+5H2O(g) ΔH=-10Q kJ
O2(g)===4CO2(g)+5H2O(g) ΔH=-10Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写不正确的是( )。
A.往NaOH溶液中通入过量CO2:CO2+OH-==HCO3-
B.H2SiO3与NaOH溶液混合:2OH-+H2SiO3==2H2O+SiO32-
C.石英砂与烧碱反应制水玻璃:SiO2+2OH-==SiO32-+H2O
D.往水玻璃中通入二氧化碳:Na2SiO3+H2O+CO2==H2SiO3↓+2Na++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。请填写以下空白。
(1)A、B、C、D的化学式分别是________、________、________、________。
(2)A→B的化学方程式是____________。
(3)C→D的离子方程式是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: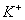 、
、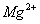 、
、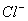 、
、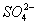
B.室温下,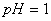 的盐酸中:
的盐酸中: 、
、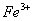 、
、 、
、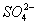
C.含有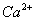 的溶液中:
的溶液中: 、
、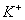 、
、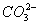 、
、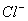
D.由水电离产生的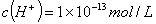 的溶液中:
的溶液中: 、
、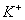 、
、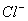 、
、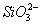
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素中按微粒半径递增顺序排列的是( )
A. K、Na、Li B.Ba2+、Ca2+、Mg2+ C. N、O、F D. Ca2+、K+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com