
【题目】关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是
A. 此混合气体中可能含有乙烷
B. 此气体中一定含有甲烷
C. 此混合气体中一定不含有丙烷
D. 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O表示的是( )
A.NaOH溶液和CO2的反应
B.Cu(OH)2和稀H2SO4的反应
C.Ba(OH)2溶液和盐酸反应
D.CaCO3和稀H2SO4的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g)![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )

A. z点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3)=5×10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和Mn3O4的工艺流程如下:
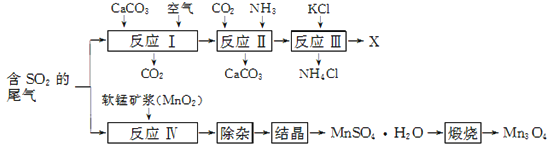
请回答下列问题:
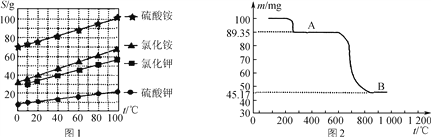
(1) 几种盐的溶解度见下如图。化肥X的化学式为________;为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应________(填操作名称),再洗涤、干燥晶体。
(2) 检验X样品是否含有氯化物杂质的实验操作是________。
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:____________________。
(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为________。
② 该样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是__________(填序号)
A.氢 B.碳 C.氧 D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有铝元素?___________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为:________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 _____________________________。
信息⑤:X与W同主族
(5)①X与浓硫酸加热时反应的化学方程式为______________________。
②工业上通过X与W的化合物制W的单质的化学方程式为:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com